髓芯减压干细胞治疗股骨头坏死 北京股骨头坏死治疗专家 王跃庆
股骨头坏死(osteonecrosis of the femoral head ONFH)这种疾病被人们认识近300年历史,至今依然是一种难治性疾病。我国因风湿性疾病采用激素治疗较为普遍,激素导致的股骨头坏死病人较多,是我国股骨头坏死发病的重要因素。激素导致的股骨头坏死病人往往都是年轻人,最常见的疾病是肾小球肾炎、肾病、系统红斑狼疮、强直性脊柱炎和类风湿性关节炎。饮酒导致的股骨头坏死多数是青壮年。因此,股骨头坏死对人的健康、事业和家庭影响都是巨大的。这些病人因为年龄小和原有疾病不适合人工关节置换,保髋治疗是病人的强烈需要,也是医学界研究的重点。保髋治疗有很多方法,但是近20年的临床研究表明,髓芯减压细胞治疗股骨头坏死越来越受到人的重视,成为股骨头坏死,尤其是塌陷前病人的重要治疗方法。本文将近20年世界范围经典相关研究和笔者的临床经验进行总结,以期深刻了解该技术的现状、成果、存在的问题,明确发展方向,促进股骨头坏死保髋治疗的发展。髓芯减压在保髋治疗的诸多方法中,髓芯减压(core decrompression CD)加干细胞治疗损伤最小,应用最广,展现出良好的前景。这一技术的疗效究竟怎样、存在哪些问题以及进一步研究的方向是人们普遍关注的问题。 髓芯减压术由Ficat于1985年报告(Ficat RB 1985),[1]原始目的是在股骨头取活捡早期诊断股骨头还死,以后逐渐演变为一种治疗方法。目前,CD已成为治疗股骨头坏死的一种最广泛应用的保髋治疗方法,有效率达80%以上(McGrory 2007)。[2]CD的原理是通过股骨头髓芯减压解除股骨头内增高的骨内压,促进股骨头血运恢复(Lieberman 2003)。[3]但是,CD术后疗效不一,有些病人术后病变进一步发展,股骨头出现塌陷、变形,关节功能障碍,最终行人工关节置换(total hip replacement THR)。[4]CD术后股骨头病变进一步发展的原因不明,但临床影像学表面明,术后股骨头病变进一步括大,坏死区无修复现像,说明股骨头坏死病理过程依然在继续,股骨头局部缺乏修复能力。Gangji等(2003)发现,股骨头坏死区骨髓基质干细胞(mesencheymal stem cells MSCs)数量和活性均降低。[5]Jones(1985)和Mont(1995)分别发现病人股骨头内供应细胞血运的血管有栓子或血栓形成[6,7]。这些结果部分说明股骨头坏死单纯CD治疗不能够解决股骨头坏死病灶修复问题。如何能够增强股骨头坏死病灶的修复能力,促进股骨头的血运恢复是目前医学研究的焦点问题。随着干细胞技术的深入研究,股骨头坏死的细胞治疗时代已经来临,为股骨头坏死的保髋治疗开辟了一条崭新途径。干细胞治疗上世纪60~70年代就发现骨髓组织和骨髓细胞悬液体外培养能形成骨和软骨(Friederstein 1966, Rosin 1963)[8,9]。进一步研究确定形成骨和软骨的细胞是骨髓基质细胞(Bab 1986)[10]。Friedenstein确定骨髓中的基质细胞具有强大的增生能力和多能性,能分化形成骨和骨髓微环境重建所需的所有细胞系[11]。Owen(1985)将这种骨髓中的这种多能性细胞确定为骨髓基质干细胞。[12]来源于骨髓的基质干细胞能够分化成成骨细胞,加快成骨。这些细胞还能够分泌多种细胞因子,促进成骨和新血管的形成,用于治疗股骨头坏死,能够促进坏死病灶的修复,防止股骨头塌陷,避免或延缓病人行人工关节置换(Ci Q 2011)。[13]从2000年以来,一些骨科临床先驱学者陆续开始将骨髓基质干细胞用于治疗股骨头坏死,尤其是塌陷前的病人,他们是Hernigou and Beaujean (2002), Gangji and Hauzeur (2005), Calori (2014) 等。他们在CD的基础上将自体髂骨采取的MSCs植入到股骨头病变区。目前,已有越来越多的报道采用CD加MSCs移植治疗股骨头坏死,尤其是塌陷前病人,均取得了一定疗效。为证明移植MSCs的效果,有些研究人员将CD加MSCs治疗与单纯CD治疗进行对照性研究,结果,前者均优于后者。Gangji等(2011)报道随访术后5年的病例,病人症状改善,仍保持股骨头轮廓完好。[14]Sen等(2012)报道术后随访12个月,CD加MSCs组Harris hip score (HHS)改善优于单纯CD组(p∠0.02)。[15]Liu等(2013)报道术后到随访结束时CD加MSCs治疗组 HHS 和visual analog scale(VAS)2个指标均优于单纯CD组(p∠0.001)。[16]Ma等(2014)报道采用双盲前瞻性研究方法观察,结果CD加MSCs治疗组疼痛缓解和关节功能方面与术前对照均明显改善(p∠0.001)。[17]Hernigou 和Beaujean(2002)采用CD加MSCs治疗股骨头坏死189髋,术后随访7年,塌陷前病人需要人工关节置换者6%,而已有塌陷的病人有57%行人工关节置换,表明塌陷前的病人CD加MSCs能够抑制股骨头塌陷,明显减少人工关节置换比率,疗效明显高于已有塌陷的病人。[18]上述结果表明CD加MSCs治疗股骨头坏死无论是缓解症状还是改善功能都是有效的,能够明显预防股骨头塌陷,避免或延缓行人工关节置换。然而,由于股骨头坏死疾病的复杂性和各研究者采用的方法和评估标准不尽相同,所以,CD加MSCs治疗结果也存在差异。Costas等(2016)为了进一步判断究竟CD加MSCs治疗股骨头坏死是否优于单纯CD,从469项研究中筛选出7项进行元分析(meta analysis)研究以增加研究结果的可信度。[19]该研究将预防股骨头塌陷和转为行人工关节置换的比率这两项关键因素作为判断指标,与单纯CD进行对照研究。结果,以股骨头塌陷为判断指标,421例病人中,CD加MSCs治疗组股骨头塌陷比单纯CD治疗组降低5倍(p∠0.02),其中股骨头塌陷前病人CD加MSCs治疗组比单纯CD组降低8倍(p∠0.01)。以人工关节置换为判断指标,208例病人,到随访结束时,CD加MSCs治疗组5%需要行人工关节置换,而CD治疗组则有16.8%需要行人工关节置换。研究表明CD加MSCs能够防止股骨头塌陷,预防或延缓人工关置换。笔者的观点和经验尽管CD加MSCs治疗股骨头坏死已经展现出良好的前景,股骨头还死的治疗至今依然是世界性难题,有很多方面还需要进一步研究,其中,极为令人期待的研究焦点包括:采用更为微创的方法达到股骨头彻底减压。手术中导航判断病变范围和减压程度。确定不同的病变范围植入不同的细胞量和植入方法。植入股骨头内的细胞在病灶修复过程中作用动态观察。股骨头部分塌陷的病人保髋治疗的价值。促进股骨头病灶修复和关节功能恢复的康复治疗。笔者从1990年开始研究骨髓基质干细胞的成骨性能。通过动物实验证明,载体加骨髓抽吸物移植促进成骨,并将该技术应用到股骨头坏死、距骨坏死、长管状骨坏死和股骨颈骨折不愈合的治疗。在股骨头坏死治疗中,利用闭合腔隙加压原理采用“树突”状髓芯减压治疗股骨头坏死,然后植入自体复合骨髓组织,通过“种子、载体、土壤”三要素修复股骨头还死病灶,术后采用28套康复训练方法,取得了一定疗效。术后观察,虽然部分病人术后仍需要行人工关节置换,大部分病人疼痛得到缓解,关节功能改善,肌肉力量增强。有不少病人随访5~10年,至今依然能够正常生活,甚至从事重体力劳动。有效的病人X片和MRI复查可以看到股骨头坏死病程得到抑制,病变未进一步发展。股骨头坏死病因和发病机制未完全清楚,临床观察其病理变化复杂,不仅仅局限于股骨头。MRI显示股骨头坏死除股骨头信号改变外,很多病人还存在关节软骨受累,股骨颈和股骨上端大片水肿,关节腔积液。手术中发现,一些病人阔筋膜和髂胫束肥厚,髂骨脂肪沉积,髋关节周围肌肉挛缩。因此,股骨头坏死保髋手术仅仅是治疗的一部分,手术后还需要必要的中西医药物治疗和系统的康复训练。笔者在临床实践的基础上建立了完整的股骨头还死康复治疗系统,包括肌肉挛缩松解和关节功能训练。能够根据病人病变程度和手术后不同时期制定不同的康复治疗方案。虽然每一个病人方法不同,但基本的目标是松解肌肉挛缩,改善关节活动度,润滑关节软骨,促进病灶区成骨。临床观察,能够坚持积极康复训练的病人更容易获得好的疗效。总结股骨头还死是一种难治性疾病,发病率高,保髋治疗越来越受到重视。多项临床对照研究和元分析研究表明CD加MSCs治疗疗效优于单纯CD。MSCs能够为股骨头病灶修复提供成骨性细胞,并能分泌多种细胞因子,促进股骨头内血管再生。CD加MSCs为股骨头坏死保髋治疗开辟了新的途径。CD加MSCs治疗股骨头坏死还有很多方面需要进一步研究。术后中西医药物治疗和康复治疗有利于提高疗效。参考文献1.Ficat RP. Idiopathic bone necrosis of the femoral head. Early diagnosis and treatment. J Bone Joint Surg Br 1985;67(1):3~92.McGrory BJ, York SC, Iorio R, Macaulay W, Pelker RR, Parsley BS, Teeny SM. Current practice of AAHKS members in the treatment of adult osteonecrosis of the femoral head. J Bone Joint Surg Am 2007;89(6):1194-204. 3.Lieberman JB, Berry DJ, Mont MA, Aaron RK, Callaghan JJ, Rajadhyaksha AD, Urbaniak JR. Osteonerosis of the hip: management in the 21st century. Instr Course Lect 2003;52:337-55. 4. Yoon TR, Song EK, Rowe SM, Park CH. Failure after core decompression in osteonecrosis of the femoral head. Int Othop 2001;24(6):316-8.5.Gangji V, Hauzeur JP, Schoutens A, Hinsenkamp M, Appelboom T, Egrise D. Abnormalities in the replicative capacity of osteoblastic cells in the proximal femur of patients with osteonecrosis of the femoral head. J Rheumatol 2003;30(2):348-516. Jones JP. Fat embolism and osteonecrosis. Qthop Clin Noth Am 1985;16(4)595~633.7.Mont MA, HungerfordDS. Non-traumatic avascular necrosis of the femoral head. J Bone Joint Surg Am 1995;77(3):459~74.8.Friedenstein AJ, Piatzky-Shapiro II, Petrakavo KV. Osteogegnesis in transplants of bone marrow cells. J Embryol Exp Morpgol 16:381,1966.9.Rosin A, Freiberg H, Zajicek G. The fate of rat bonge marrow, spleen and periosteum cultivated in vivoin the diffusion chamber with specific reference to bone formation. Exp Cell Res 29:176,1963.10.Bab I, Ashton BA, Gazit D, Marx G, Williamson MC, Owen ME. Kinetic and differentiation of marrow stromal cells in diffusion chambers in vivo. J Cell Sci 84:139,1986.11.Friedenstein AJ, Chailakhyan RK, Gerasimov UV. Bone marrow osteogenic stem cells: In vitro cultivation and transplantation in diffusion chambers. Cell Tissue Kinet 20:263,1987.12.Beresford JN. Osteogenesic stem cells and the stromal system of bone and marrow. Clin Othop Relat Res 240:270-280.13.Cui Q, Botchwey E. Threatment of precollapse osteonecrosis using stem cells and growth factors. Clin Othop Relat Res 2011;469:2665-9.14. Gangji V, De Maertelaer V, Hauzeur JP. Autologous bone marrow cells implantation in the treatment of non-traumatic osteonecrosis of the femoral head: 5 year follow-up of a prospective control study. Bone 2011;49(5):1005-9.15.Sen RK, Tripathy SK, Aggarwal S, MarvahaN, SharmaRR, Khandelwal N. Early results of core decompression and autolguos bone marrow mononuclear cells instillation in femoral head osteonecrosis: a randomized control study. J Arthroplasty 2012;27(5):679-86.16.Liu Y, Liu S, Su,X. Core decompression and implantation of bone marrow mononuclear cells with porous hydroxylapatic composite filter for the treatment of osteonecrosis of the femoral head. Aech Othop Trauma Surg 2013;133(1):125-33.17.Ma Y, Wang T, Liao J, Gu H, Lin X, Jiang Q, Bulsara MK, Zheng M, Zheng Q. Efficacy of autologous bone marrow buffy caot grafting combined with core decompression in patients with avascular necrosis of femoral head: a prospective, double-blinded, randomized, controlled study. Stem Cell Res Ther 2014;5(5):115.18.Hernigou P, Beaujean F. Treatment of osteonecrosis with autologous bone marrow grafting. Clin Othop Relat Res 2002;405:14-23.19.Costas P,Theodoros HT, Elena J, Peter VG. The role of “cell therapy” in osteonecrosisof the femoral head. Acta Othop 2016;87(1):72-78.


出现股骨头坏死可以治愈吗?

治疗无菌性股骨头坏死的方法是什么?

股骨头坏死会自愈吗 股骨头坏死怎么治疗

股骨头坏死会复发吗?快点击查看
置换手术治疗股骨头坏死会产生什么影响呢?


对于股骨头坏死的预防方法介绍

治疗股骨头坏死多少钱?
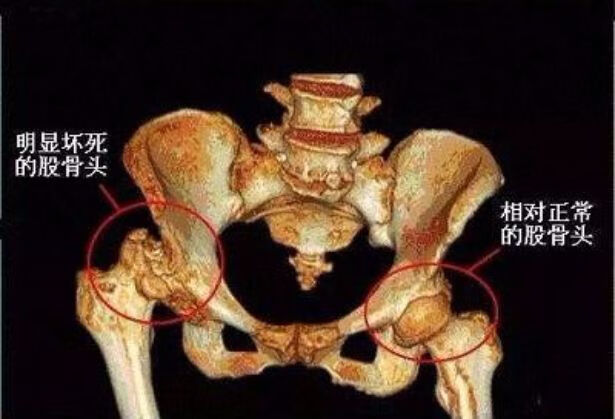
股骨头坏死临床症状和治疗方法

几种股骨头坏死的治疗方法


股骨头坏死患者如何饮食保健,你了解多少?


变幻莫测的老年人股骨颈骨折

北京通州区的股骨头坏死患者:互联网医院的温暖守护

股骨头坏死治疗多久能好

治疗股骨头坏死的药物都有哪些

屁股像针刺痛怎么回事

治疗儿童股骨头坏死的方法

沈阳关节科线上问诊:股骨头置换的温暖之旅

洛阳骨科专家线上会诊股骨头坏死,患者感受互联网医疗的温暖

创伤性股骨头坏死的诊断

孕期股骨头坏死的治疗怎么进行
营养科医生为股骨头损伤患者提供通便建议
髋骨关节炎是否需要手术置换
半导体激光治疗仪在特定情况下的使用指南
股骨头磨损营养补充咨询
股骨头损伤及术后恢复咨询
股骨头摔断后遗症的治疗与护理
疱疹愈合后皮肤瘙痒及股骨头扭伤治疗咨询
关节软骨保健营养咨询
脑梗后遗症床垫选择及护理建议
股骨头扭伤康复咨询




