 京东健康互联网医院
京东健康互联网医院
 网站导航
网站导航
广西医科大学口腔医学院、广西医科大学附属口腔医院(广西壮族自治区口腔医院)是国家一级学会—中华口腔医学会副会长单位,是广西口腔医学教学、科研、医疗、保健中心,是国家三级甲等口腔专科医院,全国百姓放心示范医院,为国家级住院医师规范化培训基地、国家口腔颌面外科专科医师规范化培训基地,为国家医师资格考试实践技能考试基地与考官培训基地(口腔类别)。1935年始建口腔科,1978年设置口腔医学专业,1983年成立口腔医学系,1985年获口腔临床医学硕士学位授予权,1992年开始招收留学生。1993年建立附属口腔医院,2000年获全国首批口腔医学临床硕士学位授予点,2007年开始招收博士研究生,2018年获口腔医学一级学科博士学位授权点和口腔医学博士专业学位授权点,2019年获口腔医学国家级一流本科专业建设点、广西口腔科临床重点专科建设项目单位。现有临床医技科室21个,住院病区3个,口腔综合治疗椅233张,开放病床104张,2019年门诊量逾30万人次,住院病人逾2300人次。医院多项技术处于广西甚至全国领先地位,2014-2019年连续六年荣膺中国“最佳专科医院”提名。学(医)院占地面积9387.5平方米,医疗、教学用房建筑面积24080.83平方米,是国家级特色专业建设点、国家级人才培养模式创新实验区,自治区优势特色专业建设点,口腔医学专业被评为自治区级优质专业,入选广西“一流学科”,形成了口腔医学本、硕、博完整的招生体系,并招收国际学生。学(医)院师资力量雄厚,现有教职工595人,其中高级职称76人,博士生导师6人,硕士导师29人,博士29人,硕士171人,享受国务院政府特殊津贴专家4名、“长江学者和创新团队发展计划”创新团队带头人1名、国家百千万人才国家级人选1名、国家有突出贡献中青年专家1名、教育部新世纪优秀人才1名、香港霍英东教育基金会第十三届全国高校青年教师奖1名、广西八桂学者1名、广西特聘专家1名、广西优秀专家2名、广西“新世纪十百千人才工程”第二层次人选3名、广西杰出青年基金入选者1名。拥有自治区级教学团队1名。担任中华口腔医学会副会长1名,各主干学科专业委员会常委14名、委员29名。聘请院外客座教授28名。形成了一支教学和科研能力较强、以中青年教师为骨干、适应学科发展定位、满足人才培养需要、具有良好发展潜能的师资队伍。学(医)院积极落实国家“一带一路”倡议,作为主席单位,连续10年成功举办六届“中国—东盟国际口腔医学交流与合作论坛”论坛;承担国家卫生健康委“中国—柬埔寨口腔医疗合作探索”“中国—老挝口腔医疗合作探索”项目,国家教育部“丝路‘1+1’中国—老挝口腔医学教育援外项目”“丝路‘1+1’中国—柬埔寨口腔医学教育援外项目”等,在东盟各国享有极高的声誉和威望。学院秉承“国际化、精英化”的教学理念,先后与欧美日、东盟及港澳台等10多个国家和地区建立了友好合作关系,与美国哥伦比亚大学、美国纽约大学、美国天普大学、墨西哥国立自治大学、荷兰奈梅亨大学、柬埔寨卫生科学大学、台湾台北医学大学、台湾高雄医学大学、台湾中山医学大学等院校分别缔结为友好学院,每年互派师生交流,积极构建国际化教育教学平台,逐步实现口腔医学教育国际化的发展定位。先后引进德国KAVO仿真头模系统、DDS-100数字化牙科临床技术引导及升级系统、荷兰MOOG虚拟牙医培训系统等先进教学设备;积极打造口腔医学虚拟仿真实验教学中心、标准化口腔临床技能模拟实践教学培训基地;自主开发自助式高清多媒体教学视频录播系统、口腔医学网络考试平台、3D高清实时手术直播平台等;开展校企合作,设立校内教学标准化口腔诊所。创建的“临床实践技能实习前无缝对接培训教学”模式,得到全国同行专家认可,荣获广西高等教育自治区级教学成果特等奖。历届本科生就业率达100%,口腔执业医师考试一次性通过率在全国188所口腔医学院校排名前十(最好成绩位列第三)。学(医)院实施“科研兴院”战略,以国家口腔疾病临床医学研究中心广西分中心、院士工作站、广西壮族自治区级重点实验室(广西口腔颌面修复与重建研究重点实验室)、广西临床医学研究中心(广西颅颌面畸形临床医学研究中心)和广西高校重点实验室(颌面外科疾病诊治研究重点实验室)为平台,针对广西常见口腔疾病,结合学科前沿开展科研工作。目前,已形成牙颌面畸形、缺损整复临床与基础研究,头颈肿瘤发病机制与治疗研究,口腔疾病微生物与抗感染免疫研究,口腔疾病防治研究,纳米抗体研究,干细胞研究等稳定且有鲜明特色的研究方向。学院拥有教育部“长江学者和创新团队发展计划”创新团队1个、省级重点实验室1个、广西高校重点实验室1个、广西临床医学研究中心1个、广西自然科学基金创新团队1个、广西医疗卫生重点学科1个、广西高校重点学科1个。先后承担国家自然科学基金39项,国家国际合作专项1项,“长江学者和创新团队发展计划”创新团队项目1项,973子课题1项,“十一五”国家科技支撑计划重点项目子课题2项,国际合作项目1项,“新世纪十百千人才工程”专项基金2项,共获科研经费三千余万元。发表SCI论文120多篇;申请专利36项,授权8项;先后获科技成果奖18项,其中广西科技进步奖一等奖1项、二等奖3项和三等奖4项、首届中华口腔医学研究创新奖1项、广西青年科技奖1项、广西医药卫生适宜技术推广奖一等奖5项和二等奖3项。近年来学(医)院参编全国高等院校统编教材及专著共18部,全面涵盖口腔医学专业主干课程,在口腔业界影响力显著提升。学(医)院坚持以“公益”为己任,迄今为止,共承担有13项政府口腔公共卫生项目,覆盖面惠及全区近109个县、市、区,在全区基础口腔医护人员的技能培训、项目工作的计划和实施、质量监控等方面做了积极的努力和工作,探索了一条符合广西口腔公共卫生的模式,为全区口腔公共卫生事业发展做出了重要贡献。2008年,学(医)院获批建设广西医科大学东盟国际口腔医学院,占地253.18亩,作为自治区重点项目立项,未来将建成为“辐射东盟”的国际化口腔医学教育、医疗服务、疾病预防、医学研究及职业培训中心。指的是血管发育异常增生而形成的形状,遗传性因素,肿瘤性的病变,相邻的组织器官畸形,躯干,手术治疗,血管内介入治疗,立体定向放射治疗,对症治疗,无,忌脂肪含量高的食物以及含有过多盐分的食物,血常规,血管造影,。











 6
6

 5
5

 6
6
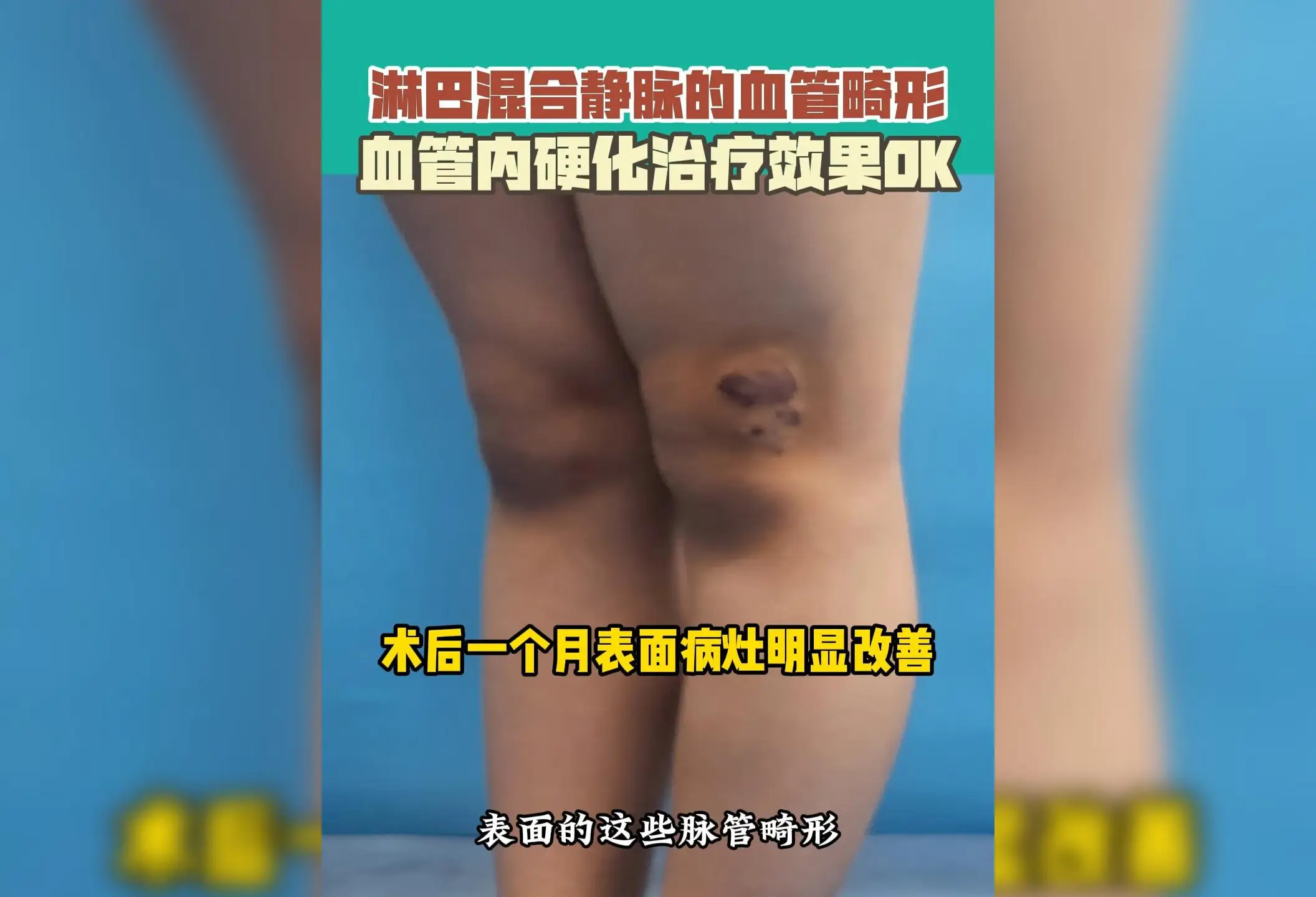
 8
8
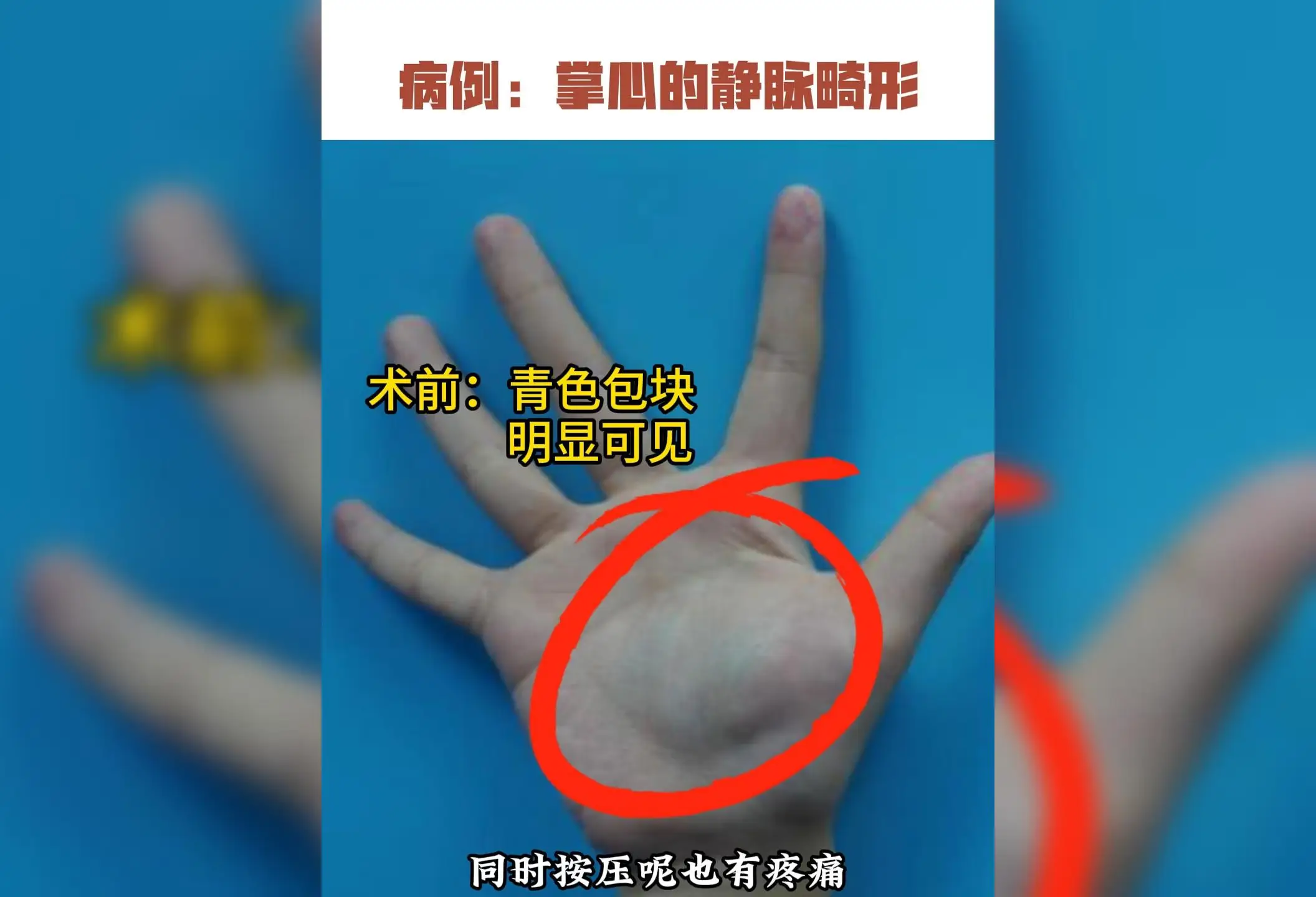
 3
3
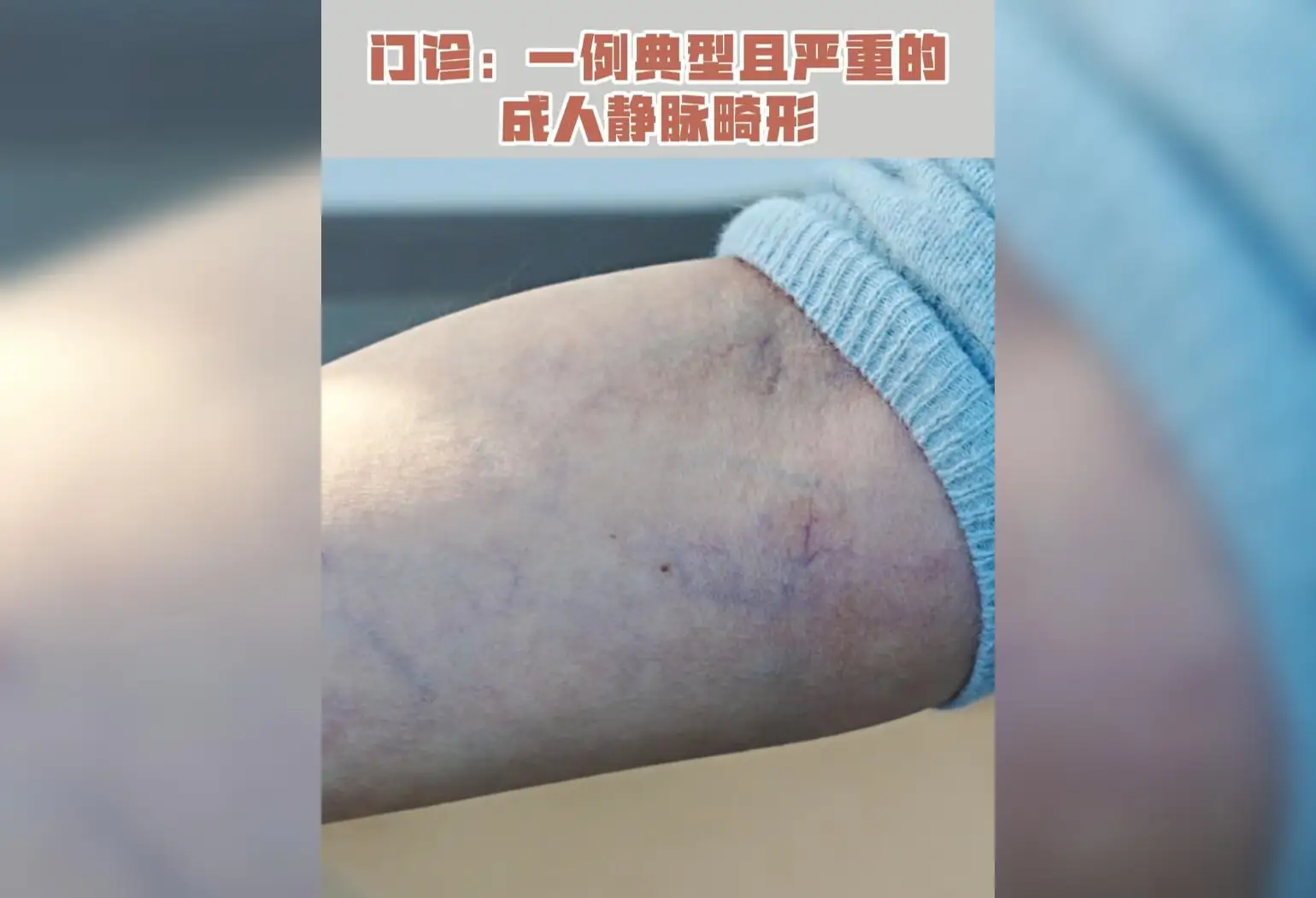
 7
7

 9
9

 0
0

 0
0

 0
0
