2024年9月10日,诺和诺德一项减肥研究登顶《新英格兰医学杂志(NEJM)》,公布了胰高血糖素样肽-1(GLP-1)受体激动剂利拉鲁肽在儿童中的减重数据:利拉鲁肽组近一半参与者BMI降低 5%以上。让我们一起来看看这项儿童减肥药的研究。
火锅烤肉、奶茶饮料等诱惑层出不穷,让不做选择的成年人慢慢走上了肥胖之路。而我们祖国的花朵,面对这些,也茁壮成长成了“小胖子”。据统计,我国6~17岁、6岁以下儿童和青少年超重/肥胖率分别达到19.0%和10.4%[1]。
孩子肥胖与很多疾病息息相关,如2型糖尿病、脂肪性肝炎、多种癌症。除了引导健康饮食和规律的生活方式[2],一些药物选择对于超重儿童提供了选择。
虽然经常提到司美格鲁肽、利拉鲁肽,但是其在儿童中的安全性一直引人担忧,于是就有了NEJM这个研究。这个研究是一项双盲随机对照试验。试验分为利拉鲁肽组和对照组,参与者每日一次注射药物,在4-5周内每周剂量递增,直至达到最终剂量[3]。试验有效性结果主要看参与者BMI变化百分比。
共有 82 名参与者接受了随机分组;56 人被分配至利拉鲁肽组,26 人被分配至安慰剂组。
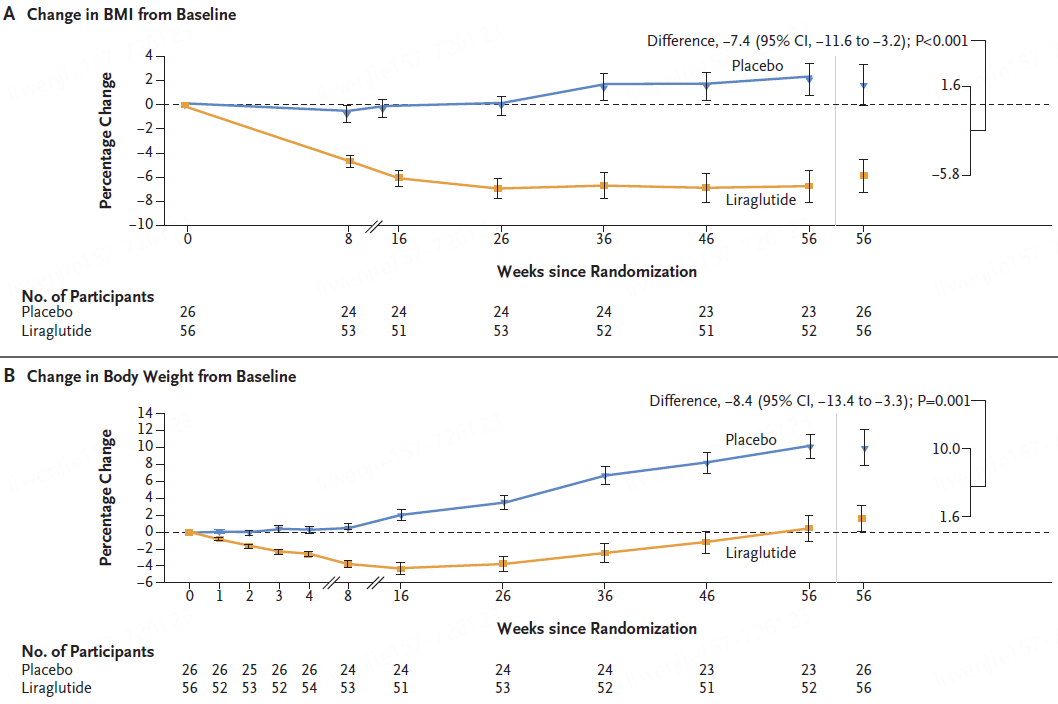
试验结果表明,在第 56 周时,利拉鲁肽组BMI较基线的平均变化百分比为 - 5.8%,安慰剂组为 1.6%。
利拉鲁肽组体重的平均变化百分比为 1.6%,安慰剂组为 10.0%。
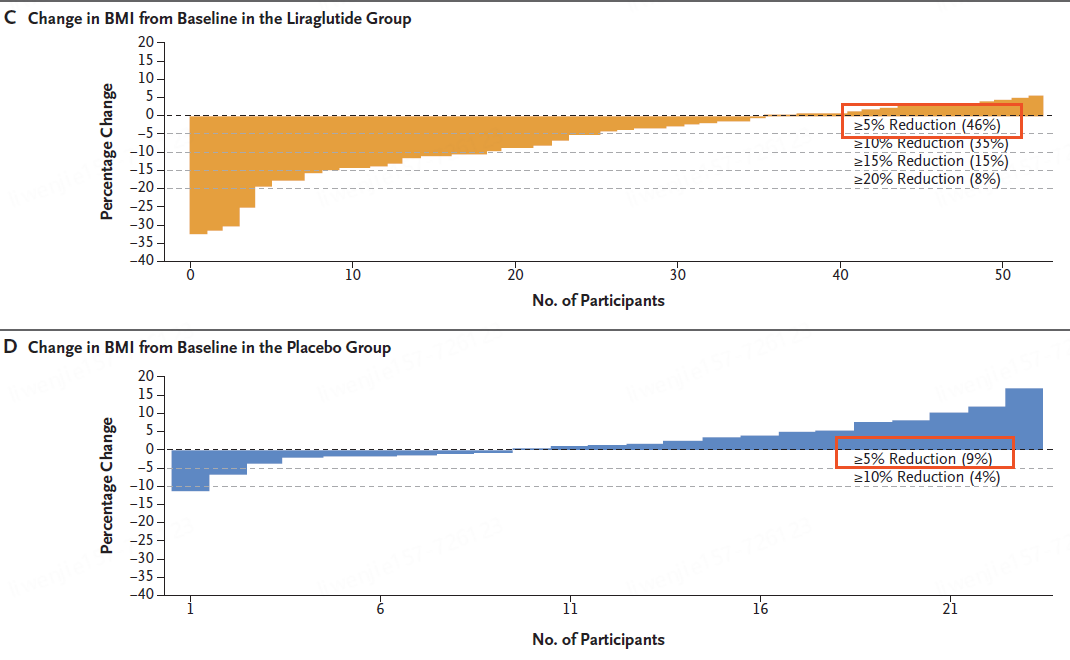
利拉鲁肽组46%的参与者BMI降低至少5%,而安慰剂组为 9%(调整后的优势比为 6.3 [95% CI,1.4 至 28.8];P = 0.02)。
利拉鲁肽组和安慰剂组分别有 89% 和 88% 的参与者发生不良事件。胃肠道不良事件在利拉鲁肽组更为常见(80% vs 54%);利拉鲁肽组和安慰剂组分别有 12% 和 8% 的参与者报告了严重不良事件。
关于利拉鲁肽
利拉鲁肽(VICTOZA)的已获批适应症包括:
作为饮食和运动的辅助手段,用于改善 10 岁及以上成人和儿童 2 型糖尿病患者的血糖控制。
降低已确诊心血管疾病的成人 2 型糖尿病患者发生主要不良心血管事件(心血管死亡、非致命性心肌梗死或非致命性中风)的风险。
说明书也也发布了黑框警告信息:
本品禁用于有甲状腺髓样癌个人或家族史的患者以及患有 2 型多发性内分泌腺瘤综合征(MEN 2)的患者。应告知患者使用本品可能存在的甲状腺髓样癌风险,甲状腺肿瘤的症状包括颈部肿块、吞咽困难、呼吸困难、持续性声音嘶哑。
关于诺和诺德[5]
诺和诺德是一家全球领先的医疗保健公司,成立于1923年,总部位于丹麦。其的宗旨是在糖尿病领域的传统基础上,推动变革以战胜严重的慢性疾病。诺和诺德通过开创科学突破、扩大药品的可及性以及致力于预防并最终治愈疾病来实现这一目标。诺和诺德在80个国家拥有约 69,000名员工,产品在大约170个国家销售。
参考文献:
1.中国超重/肥胖医学营养治疗指南(2021)
2.Fox CK, Barrientos-Pérez M, Bomberg EM, Dcruz J, Gies I, Harder-Lauridsen NM, Jalaludin MY, Sahu K, Weimers P, Zueger T, Arslanian S; SCALE Kids Trial Group. Liraglutide for Children 6 to <12 Years of Age with Obesity - A Randomized Trial. N Engl J Med. 2024 Sep 10. doi: 10.1056/NEJMoa2407379. Epub ahead of print. PMID: 39258838.
3.SCALE KIDS: Research Study to Look at How Well a New Medicine is at Lowering Weight in Children With Obesity
4.Product information:VICTOZA- liraglutide injection
5.https://www.novonordisk.com/
 京东健康互联网医院
京东健康互联网医院
 网站导航
网站导航
 1
1

 4
4
 3
3

 7
7

 14
14

 0
0
 0
0

 0
0
 0
0

 0
0
