 京东健康互联网医院
京东健康互联网医院
 网站导航
网站导航
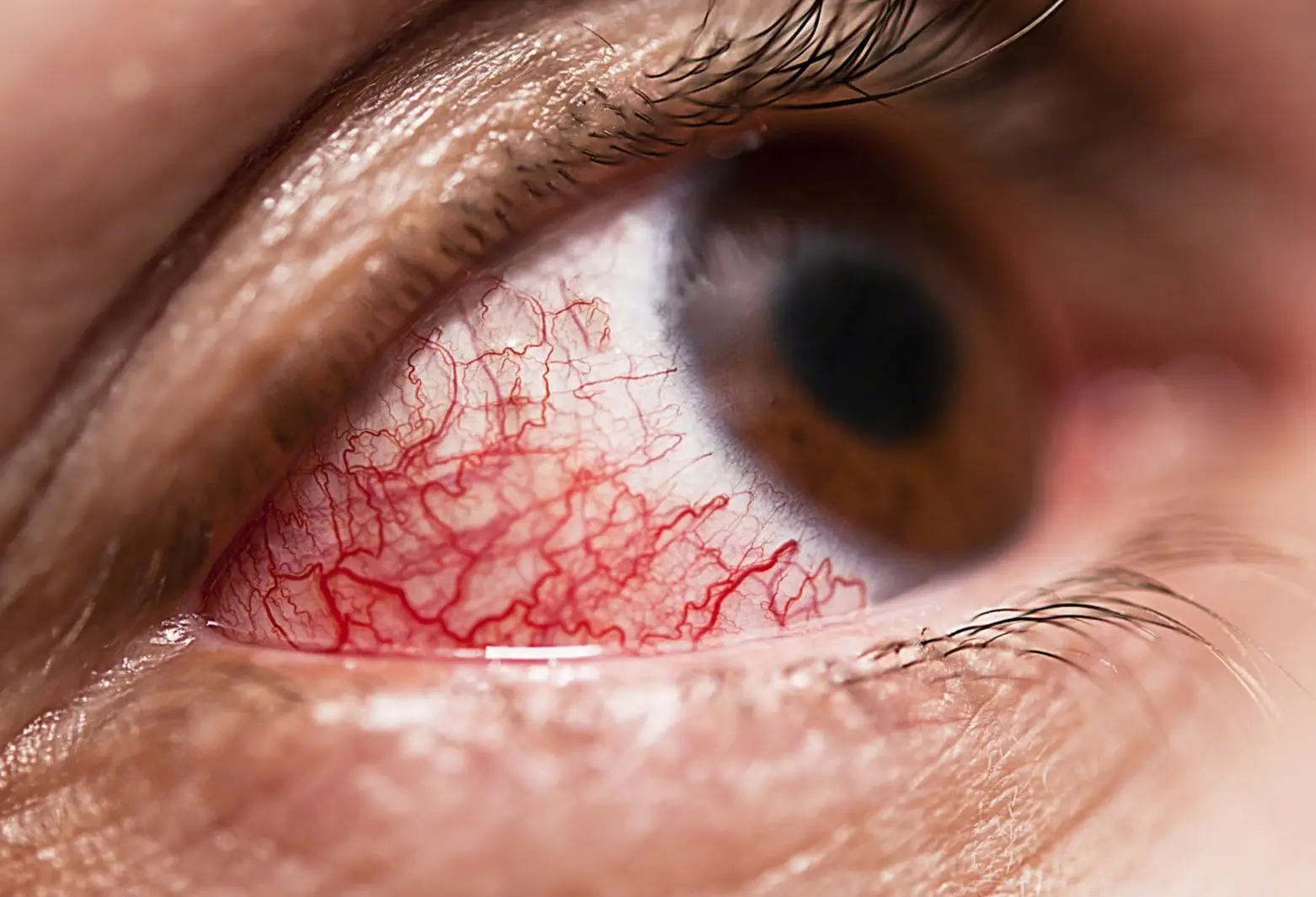
深圳市前海蛇口自贸区医院是华南地区第一家通过国际JCI质量认证并获得JCI复审金牌的综合性公立医院。成为外籍人士与港澳居民在深圳就医的首选医院之一,是深圳市涉外医疗服务量最大的医院之一。医院占地面积2.267万平方米,总建筑面积近44571.48平方米,核定床位506张,服务面积达65平方公里、服务人口接近80万。新建的综合大楼预计在2024年竣工,总建筑面积可达到13.66万平方米,床位数可开放到1200张。医院始建于1955年,目前已成为外籍人士与港澳居民在深圳就医的首选医院之一,是深圳市涉外医疗服务量最大的医院,是深圳市前海蛇口自贸区内唯一一家三级综合医院,是华南地区第一家通过国际JCI质量认证并获得JCI复审金牌的综合性公立医院;是广东省高等医学院校教学医院、广东医学院硕士研究生联合培养点、深圳市博士后创新实践基地、广东省特级档案综合管理单位、深圳市社会保险定点医院AAA信用等级单位、深圳市中医特色眩晕专科建设单位、深圳市园林式花园式单位,先后被授予“绿色医院”、“深圳市文明单位”等荣誉称号;医院在落实进一步改善医疗服务行动计划活动中表现突出,获国家卫健委医管局及健康报社颁发的表扬证书。医院拥有“特区、湾区、先行示范区、自贸区、前海合作区”为一体的五区叠加的地理优势,于2021年获批复变更第一名称为“深圳市前海蛇口自贸区医院”,医院充分利用自贸区政策,认真贯彻《中共中央国务院关于支持深圳建设中国特色社会主义先行先试示范区的意见》,以提高医疗服务能力建设为核心,落实先行示范项目,积极打造成为高端医疗卫生高地。主动承接国家政策赋予医院的四大使命:一是为患者提供国际化的医疗卫生与健康服务;二是在医疗技术、医疗服务、医学教育、医学科学、研究等方面先行先试与国际同步;三是紧跟医学科学研究前沿,注重科技成果的转移与转化,助推国内产业的升级与转型,服务国内国际经济双循环;四是与港澳的医疗卫生与健康服务无缝衔接,服务于一国两制。医院医资雄厚,现有1153人,其中医师453人、护士380人、医技130人、行政后勤160人,主任医师42人、副主任医师113人,中级以上医技护人员729人。医院提供全面的医疗保健服务。诊疗科目有预防保健科/全科医疗科/内科:呼吸内科专业:消化内科业;神经内科专业:心血管内科专业;血液内科专业;肾病学专业;内分泌专业:其他(老年医学科)/外科:普通外科专业:神经外科专业:骨科专业;泌尿外科专业/妇产科:妇科专业:产科专业:计划生育专业/妇女保健科/儿科/儿童保健科/眼科/耳鼻咽喉科/口腔科/皮肤科/医疗美容科:美容外科:美容皮肤科/传染科/肿瘤科/急诊医学科/康复医学科/麻醉科/重症医学科/医学检验科:临床体液、血液专业;临床微生物学专业:临床化学检验专业;临床免疫、血清学专业/病理科/医学影像科:X线诊断专业:CT诊断专业;磁共振成像诊断专业;超声诊断专业;心电诊断专业:脑电及脑血流图诊断专业:神经肌肉电图专业:介入放射学专业/中医科/中西医结合科。医院在全市率先引进了场强高、技术先进的超导型高磁场磁共振机---3.0T核磁共振仪;2016年投入使用的全新超高端RevolutionCT,是集能谱、宽体、速度于一体的全身X射线计算机断层扫描系统,是目前全球业界一流的CT;医院同时拥有全数字通用平板血管造影机系统(DSA)、全数字化乳腺X射线摄影系统(钼靶系统)、IU-22为主的高端彩超仪、CV-290电子内镜系统、电子支气管镜、浅表静脉曲张动力去除系统、血液透析系统、全自动生化分析仪及数字床边X光机(移动DR)等一系列的高端医疗设备。医院建立了深圳市首家静脉药物配置中心(PIVAS),同时每个病区均装备了从国外引进的国际公认有效控制院内感染的“病区一体化清洗消毒系统”。医院中央手术室拥有百级手术间2间,千级手术间2间,万级手术间7间,其中2间是一体化数字手术间,配置了C型臂、X光机、腹腔镜系统、宫腔镜电切系统、气压弹道碎石机、钬激光碎石机、等离子电刀、进口超声刀、高频电刀、手术显微镜、纤维支气管镜、视可尼喉镜等一系列先进设备,是深圳市目前设施齐全、设备先进的综合性现代化手术室之一。医院充分利用自贸区政策,积极落实先行示范项目,已经建成和正在实施八大医学平台:干细胞的临床转化应用平台、免疫细胞治疗中心、3D打印临床转化与再生医学平台、精准医学研究平台、智慧医院联合创新实验室、国际医疗服务中心、国际化的药物临床试验中心、慢病管理系统中心。医院成立“生物医学临床转化应用创新平台”,以干细胞和免疫细胞为基础核心,促进重要技术突破,推动国际引领性的原创发现,实现疾病的突破性治疗。干细胞临床转化应用中心项目于2020年启动,目前已初期建成近800㎡干细胞实验室,配有:流式细胞仪、倒置荧光显微镜、高速冷冻离心机等国际领先科研仪器设备。引进专业研究团队人员5名,其中4名博士(2人具有博士后研究经历),1名硕士。团队成员来自北京协和医学院、浙江大学、北京大学以及南方医科大学,均在干细胞及免疫细胞等领域从事多年基础与临床转化研究,具有丰富的研究背景和扎实的科研能力。目前已与院内多个临床科室就干细胞临床转化应用开展相关课题研究。同时,医院与首都医科大学附属北京天坛医院、北京大学、中山大学、中南大学湘雅二院等在干细胞临床治疗领域有较深积累的专家团队开展合作和交流。此外,还与汉盛汇融再生医学、双科生物等生物技术创新型企业达成战略合作协议,共同促进干细胞技术的临床转化和应用。生物信息学平台由哈佛大学医学院博士后领衔建立,是开展以精准医学为核心的临床转化技术研究,并服务于临床科研的大数据分析平台。可开展各类二代、三代测序数据分析,包括开展干细胞治疗、肿瘤免疫治疗、细胞治疗相关的多组学研究,各类癌症基因组、心脑血管疾病、呼吸系统疾病、肠道微生物宏基因组等数据分析,以及临床病例大数据的智能化分析。建设自贸区范围内集癌症免疫治疗、细胞治疗、疾病早期筛查、精准治疗、精准用药指导、全生命周期健康管理、临床病例大数据分析为一体的专业化生物信息学平台和国际化精准医学中心。医院3D打印临床转化与再生医学创新中心与西安交通大学卢秉恒院士团队合作,致力于3D打印临床转化应用及打造前海蛇口自贸区综合服务平台。本中心占地310坪,具有金属3D打印机,光固化3D打印机和FDM打印机等17台核心设备,与我院临床科室合作设计50余例复杂病例模型和手术导板,在深圳公立医院已率先实现自主设计和数字化椅旁即时打印口腔种植导板。医院与香港联合医务公司签约,开通“港澳居民服务中心”,实现“港医、港药、港保通”,目前有9名香港医护在前海蛇口自贸区医院执业,开展了线上、线下的全科医疗服务,开通了24家商业保险公司的医保结算业务,让港澳居民享受到熟悉的港式家庭医生服务,实现院内全科-专科转诊及跨境转诊。与香港中文大学(深圳)合作共建全科医学系,培养与港澳接轨的国际全科医学人才。2023年2月22日,深圳市前海蛇口自贸区医院正式获批广东省“港澳药械通”第二批指定医疗机构,2023年6月28日完成首批“港澳药械通”获批药品英克西兰、阿培利司的交接,这是“港澳药械通”政策首次在深圳前海和南山落地实施,对进一步推动深港两地医疗资源的互通互联有着非常重要的意义。为满足人民群众日益增长的医疗服务需求,医院积极引进“医疗卫生三名工程”,成功引进了中山大学乳腺病医院宋尔卫院士团队、首都医科大学吉训明教授的“国家脑重大疾病研究院深圳分中心”、中山大学附属三院高新教授微创泌尿外科高水平团队等近14个三名工程团队,以搭建高水平的专业化团队。医院重视教学工作并积极与国内知名高等医学院校建立合作关系,推动学科建设和医院发展。2009年成为广东省普通高等医学院校教学医院,2011年成为广东省全科医学教育临床教学基地,2017年成为国家级住院医师规范化培训协同基地。2011年与中南大学湘雅二医院签署医疗合作协议,挂牌“中南大学湘雅二医院深圳医院”。在湘雅二院的大力支持下,逐步成立了“重症监护室”及“血透室”,并开设了湘雅专家门诊。与湘雅二院的合作,使医院在品牌建设、学科发展、医疗技术和服务水平等方面均得到显著提升。2019年成为暨南大学医学部研究生联合培养基地,2022年成为广东医科大学研究生联合培养点。现有博士研究生导师3人、硕士研究生导师7人。与香港中文大学(深圳)医学院共建全科医学临床学系和国际化全科医学临床学院,共建全科医学专科培训基地,开展国际化医学教育。2022年起承接香港中文大学(深圳)医学院临床医学生在港澳居民服务中心开展国际全科临床见习。为推进公共卫生强区和智慧医疗城区建设,提高工作效率,提升满意度,医院加快互联网医院建设进程,于2020年获批复增加第三名称“深圳市前海蛇口自贸区医院互联网医院”。我院追踪国际医学及互联网科学前沿,拥有互联网诊室、远程诊室、直播间、互联网展厅等功能房间,开展线上健康咨询及慢病管理等业务,打通线上线下全流程就医环节。利用5G+AI+物联网在医学领域的运用研究,实现多个国内创新:创建“港医通”就医平台;率先在国内实现“先全科后专科”的互联网诊疗模式;建立“医联体-社康中心”线上平台,以及国内外合作医疗机构,通过互联网平台,形成自贸区医院的医疗服务生态圈。和华为、中国联通、梦网物联联合开发隔离酒店智慧管理平台,获第五届“绽放杯”5G应用征集大赛公共安全专题赛决赛,该项目建设方案荣获全国二等奖。医疗质量是医疗安全的核心和保证,医院通过狠抓医疗核心制度的落实,规范医疗行为,提高医疗质量等工作,2015年第一次参加“深圳市医疗服务质量评估”三级医院组评审,即在全市13家区级三级医院中,获得第四名的好成绩,目前医院正在有步骤地开展创建工作。在2011—2016年间医院连续六年荣获“深圳市医疗服务质量评估A级称号”;2016—2022年,连续七年被评为“院前急救工作先进单位”。2018年,医院顺利通过国家胸痛中心认证,成为深圳市第8个国家级胸痛中心,2018—2020年医院胸痛中心连续3年在年度质量检查评估(基层版)中获得全市第一的好成绩。2022年成功通过标准版胸痛中心认证,并顺利完成PCCM国家规范化建设标准认证工作。2023年,我院卒中中心建设喜获省卫健委“卒中防治中心”授牌。医院将坚持深化改革与创新驱动,抢抓“五区驱动”机遇,承接国家战略,对标世界一流城区医疗卫生与健康服务体系,努力将自贸区医院建设成为临床、科研、教学及管理协调发展的综合医院和国家级创新型自贸区医院。发生于结膜组织的炎症性病变,病原微生物感染,外界的理化因素,如光、各种化学物质,眼部,冲洗结膜囊,不要遮盖患眼,局部用抗菌药物或抗病毒滴眼剂,角膜炎,避免辛辣刺激及油腻食物,建议多吃富含维生素的蔬菜水果,结膜刮片,结膜的细菌学检查、分泌物的细菌培养和药敏试验,。












 42
42
 143
143

 6
6

 0
0

 0
0
 0
0

 0
0
 0
0
 0
0
 0
0
