京东健康互联网医院
京东健康互联网医院
 网站导航
网站导航
上饶市人民医院始建于1940年,初称“江西省第六行政区中心卫生院”,解放前和建国初期称“江西省立上饶医院”,1970年改名为“江西省上饶地区人民医院”,2000年撤地设市后改称为“江西省上饶市人民医院”。是一所集医疗、科研、教学、康复及预防保健于一体的三级甲等综合医院,为国家级住院医师规范化培训基地、国家药物临床试验机构、南昌大学附属上饶医院。经过80余载薪火相传,接续奋斗,现已发展为上饶市规模最大、技术力量最雄厚、医疗设备和管理以及服务理念最先进的现化代医院,承担着全市793万人口的医疗、康复、预防保健等任务。医院设有水南和城北两个院区。水南院区占地面积3.9万平方米,医疗用房建筑总面积108663平方米,开设病区12个,设置床位510张。城北院区占地113亩,建筑面积15.6万平方米,开放病区39个,设置床位1490张。医院2022年门急诊量84.1万人次,年收治病人6.49万人次,手术及操作4.31万台次。医院现有在岗职工1949人,其中专业技术人员1739人,高级专业技术职称234人,博士6人、硕士317人。医院现有12人被列为南昌大学2021年新增选校内专业型硕士研究生指导教师,并于2022年招收13名硕士研究生。2022年我院DRG在全省44家三级甲等综合医院中排名第6,在设区市三级综合医院中排名第2。医院致力于提高医疗技术水平,积极开展高、新科技项目,如人工体外膜氧合技术(ECMO)、体外循环下升主动脉人工血管置换术、全脊柱内镜下椎管减压、髓核摘除、椎间植骨内固定术(endo-plif)、帕金森病DBS植入术、全腹腔镜肝门胆管癌根治性手术、主动脉瓣膜置换(TAVA)手术、外周血干细胞采集术、儿童连续血液滤过技术(CRRT)、体外循环下心脏粘液瘤切除术、胆红素双重血浆吸附技术、内镜下黏膜下层挖除术(ESE)、心脏介入手术、呼吸介入手术等均达到省内先进、市内领先水平,为广大患者的健康保驾护航。医院不断引进尖端医疗设备,拥有美国GE3.0T、1.5T磁共振、美国GE256排螺旋CT、瓦里安高能医用电子直线加速器、西门子大型C臂血管造影机、德国sorin人工心肺机(体外循环机ECMO)、SPECT、四维彩超、波士顿科学冠状动脉内血管内超声、荷兰飞利浦智能乳腺全容积超声系统、以色列AlmaLasersLtd激光和脉冲工作站、全自动生化免疫流水线、波科国际YAG倍频激光治疗机、荷兰MMS胃肠动力学检查系统、无创肝纤维化检测仪、4K超高清腹腔镜手术系统、德国大通道椎间孔镜系统等医疗仪器设备,为临床诊疗水平的提高提供了硬件支撑。医院先后荣获全国医药卫生系统先进集体、全国模范职工小家、江西省卫生系统先进集体、江西省群众满意医院、江西省卫生系统行风建设先进单位、江西省卫生科技创新先进单位、全省医保定点2A单位、市级文明单位、消费者诚信单位等荣誉称号。医院始终秉承“团结奉献、科学严谨、崇德精医、开拓发展”的院训,持续提升医疗质量、安全和服务水平,努力打造成为赣东北区域医疗中心。皮肤老化的表现之一,因局部多巴阳性的黑素细胞减少引起。,病因不明,可由多种致病因素引起,皮肤,药物治疗为主,必要时进行物理治疗、手术治疗,色素减退斑、白癜风,饮食宜清淡,多吃新鲜蔬菜、水果,多饮水。控制乳制品的摄入量。避免辛辣、高脂、高糖食物。少喝浓茶、咖啡。忌酒,体格检查,实验室检查,组织病理学检查,皮肤镜检查,。
 4
4

 78
78
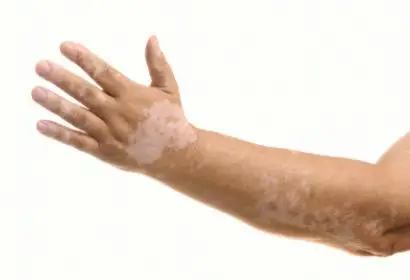
 47
47
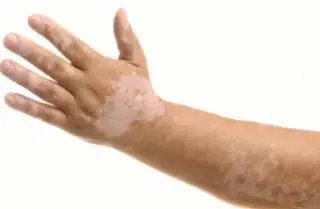
 0
0
 0
0

 0
0
 0
0

 0
0

 0
0
 0
0