你关心过自己的下巴健康吗?这个你每天都会用到,但常常忽视的地方,其实也会罢工“生锈”。日常生活中你有没有遇到这样的情况:张大嘴巴后,下巴就像生锈一样,再也合不上;一闭口,耳朵前方的关节就痛;吃饭、说话、打哈欠时,只要下巴一动,耳朵前方的关节就会像生锈一样,发出咔咔的响声,让你觉得不舒服。
其实,这些问题的症结就在于这个“耳朵前方的关节”—— 颞下颌关节, 而所谓的下巴“生锈”,其实这就是TMD(Temporo-mandibular Disorders)颞下颌关节紊乱病!
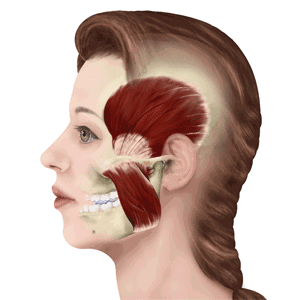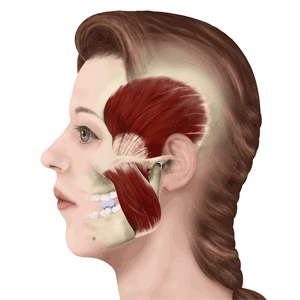
据调查,颞下颌关节病在人群中的发病率在87%左右,连偶像王源也因为这个病上过热搜。

由于人们对颞下颌关节病了解甚少,不知道这是疾病,也不知道去哪里看这样的病。
颞下颌关节紊乱伴随的症状不仅仅局限于颞下颌关节区域。在一项纳入4528例TMD患者的回顾性研究中,最常见的主诉体征和症状是:
●面部疼痛(96.1%):
呈强弱不定的持续性钝痛。疼痛可放射至耳部、颞及眶周区域、下颌角并经常放射至颈后。疼痛可每日出现或间歇出现。
●耳部不适或功能障碍(82.4%):
耳痛、耳塞和耳鸣 。支配翼内肌(运动时帮助稳定下颌骨)的三叉神经也支配中耳肌肉。鼓膜张肌和腭帆张肌也包绕着上颌骨的钩槽,因此TMD可出现耳科症状。
●头痛(79.3%):
与TMD有关的典型头痛是一种放射至颌部、颞区或颈部的单侧耳痛或耳前痛。这种疼痛是深部、钝性、持续性、中等强度的疼痛,通常在早晨加重。
●颞下颌关节不适或功能障碍(75.0%):
下颌活动范围减小,张口度减小或表现可描述为无法张口。颌部活动时关节区咔哒声或弹响声。部分可出现关节绞锁,伴随张口过程中下颌
颞下颌关节紊乱伴随这么多复杂的症状,件件影响我们的日常生活,那的确是相当恼人。颞下颌关节是一个滑动关节,滑膜液是其重要的关节润滑剂,当滑膜液减少或消失后,关节就出现了所谓的“生锈”症状了。因此,在颞颌关节腔中注入透明质酸钠凝胶或医用几丁糖作为“润滑剂”,是目前治疗颞颌关节病的重要方法之一。”
透明质酸(hyaluronate,HA)
透明质酸(hyaluronate,HA)是关节液的主要成分之一,是一种高分子均聚糖,它在关节润滑液中的含量为1.45-3.12g/L,平均为2.3g/L。它在关节中的生理作用主要为润滑作用,既减少关节运动的阻力,又保护了关节软骨和骨膜;其次是分子筛作用,既为软骨等组织提供营养物质,也成为细菌、毒素和免疫复合物等的天然屏障;
同时HA对细胞发育有调控作用,能增强成纤维细胞的动力,增加细胞表面发泡和皱折,还能抑制软骨细胞中软骨蛋白多糖的生物合成。颞下颌关节出现骨关节病时,关节滑液里的HA浓度会明显降低,导致滑液不能发挥其正常的生理功能。透明质酸钠凝胶的功能已经得到临床验证,HA可以保护软骨或使破坏的软骨再修复,改善患者关节区的疼痛、肿胀及积液等问题。

今年23岁的小翁,一直被自己的“下巴病”所困扰。她每次张口,无论吃饭还是说话,耳朵前方的关节都会发出“咔咔”的响声,还经常张口疼痛,这些不仅使她在人前很尴尬,而且也生活也痛苦不堪。后来他在朋友的引介下来找武汉第一口腔医院张军医生就诊,诊断为“颞下颌关节紊乱病”。
小翁接受了“保守综合治疗”:
1.在颞下颌关节腔内注射透明质酸钠凝胶;
2.利用红外、激光及超声波照射修复关节软骨;
3.对颞下颌关节进行手法按摩复位;
4.佩戴关节矫治器治疗。
经过张军医生的系统治疗后,小翁的困扰全部得到了解决,生活恢复了正常。
像小翁这样的病人还有很多, 武汉第一口腔医院香港路院区 采用“梯度、无创、舒适化”的模式治疗各型颞下颌关节紊乱病,取得良好疗效,受到广大求医无门的颞下颌关节病患者的好评,只要早发现,早治疗,就能避免病情加重,尽早恢复正常生活。
 京东健康互联网医院
京东健康互联网医院
 网站导航
网站导航
 17
17

 21
21

 2
2

 0
0

 0
0

 0
0

 0
0
 0
0

 0
0

 0
0
