 京东健康互联网医院
京东健康互联网医院
 网站导航
网站导航
山东大学齐鲁医院是国家卫生健康委委属(管)的三级甲等综合医院,教育部直属重点大学——山东大学的直属附属医院、山东大学第一临床学院,是首批委省共建国家区域医疗中心牵头和主体建设单位,国家区域医疗中心建设输出医院。医院始建于公元1890年,先后称华美医院、共合医院、齐鲁医院、山东医科大学附属医院等,2000年10月更名为山东大学齐鲁医院。建院133年来,医院秉承“博施济众、广智求真”的医院精神,遵循“医道从德、术业求精”的院训,打造形成了门类齐全的学科体系、实力雄厚的人才队伍和国内先进的医疗、教学、科研平台,在海内外享有盛誉。近年来,医院坚持立足山东、面向全国、放眼世界,实施“医疗立院、学科强院、人才兴院、依法治院、党建领院”五大发展战略,围绕“三中心一试点”战略目标,全力创建综合类国家医学中心、国家临床医学研究中心、国家区域医疗中心和国家公立医院高质量发展试点医院,致力于建设国内一流、国际知名高水平研究型医院。医院打造了高质量的医疗服务体系。医院现实际开放床位4000张,2022年在完成疫情防控和重症救治任务的同时,实现总诊疗人次268.52万,出院人次18.76万,手术台次14.90万。在2021年度国家三级公立医院绩效考核中,医院位列全国第13位,进入A++行列,其中代表医院诊疗病例技术难度以及收治疑难重症能力的病例组合指数(CMI)位列全国第6位,衡量医院开展疑难复杂手术数量的四级手术人次位列全国第9位;2022年山东省公立医院绩效考核排名全省第1位。医院打造了高质量的科学研究体系。打造贯通基础研究、临床研究、成果转化的一体化全链条科技创新公共服务平台,现有省部级以上科研平台和机构36个,获批国家医学攻关产教融合创新平台(医工结合方向)、国内第一个省部级以上零磁医学科研平台——山东省零磁医学重点实验室。“十三五”以来,承担国家重大重点项目39项、省部级重大重点项目31项。获得国家科学技术奖(自然科学)二等奖、何梁何利基金2020年度科学与技术创新奖、中华医学会医学科技一等奖、第十七届中国青年科技奖等荣誉,近5年累计获得省部级一等奖16项。2022年获批国家自然科学基金105项,在全国医疗机构中位居前列。医院打造了高质量的教育教学体系。在第五轮学科评估中临床医学被评为A类学科,临床实践教育质量位列全国高校附属医院第12位。承担山东大学临床医学从本科到博士的教学任务,设有临床医学一级学科博士学位授权点,覆盖所有二级学科,设有博士后流动站。临床医学专业入选国家双一流建设学科。在岗博导162人、硕导499人。近十年主编国家级规划教材11本,有《现代妇产科进展》《中国现代普通外科进展》《腹腔镜外科杂志》等3种国内外公开发行的学术刊物。医院是我国最早开展住院医师规范化培训的单位之一,是国家首批24家住院医师规范化培训示范基地之一、国家首批专科医师规范化培训试点基地,拥有住培专业基地31个,专培试点专业基地10个,国家级住培骨干师资培训专业基地16个,国家住培重点专业基地5个。建有国内先进的临床技能培训中心,搭建全过程、全周期、全链条的临床技能培训管理体系,年培训量约3.6万人次。医院打造了高质量的学科体系和人才队伍。医院职工6695人,临床医技科室61个,国家重点学科和国家临床重点专科22个。在复旦版《中国医院专科声誉排行榜》和《中国医院专科综合排行榜》中,医院有9个学科跻身全国专科榜十强(9个学科分别为:急诊医学、康复医学、神经外科、血液学、妇产科、全科医学、心血管病、检验医学、消化病),11个学科获得全国十强提名(11个学科分别为:神经内科、内分泌科、老年医学、病理科、健康管理、耳鼻喉科、超声医学、心外科、风湿病、普通外科、骨科)。始终秉承“人才兴院”战略,形成了尊重人才、爱护人才、服务人才、成就人才的良好生态。现有中国工程院院士、国家杰青等国家级高层次人才15人,泰山学者69人,国家和省部级突出贡献中青年专家20人。设有博士后科研工作站,在站博士后人数一年破百。医院始终高举公益性旗帜,勇担应急性任务,争做医教研标杆,全面贯彻党和国家的卫生健康工作方针、教育工作方针,胸怀“两个大局”,心怀“国之大者”,完整、准确、全面贯彻新发展理念,主动服务和融入新发展格局,以人民健康为中心,以高质量发展为主题,以改革创新为动力,以“十四五”事业发展规划为指引,以创建国家医学中心为抓手,全面推进医教研防管融合发展,着力提升医院综合实力,努力建设成为国内领先、世界一流的临床医学高峰、领军人才培养基地和科研成果转化高地,在中国式现代化进程中努力打造公立医院高质量发展的“齐鲁样板”。指的是血管发育异常增生而形成的形状,遗传性因素,肿瘤性的病变,相邻的组织器官畸形,躯干,手术治疗,血管内介入治疗,立体定向放射治疗,对症治疗,无,忌脂肪含量高的食物以及含有过多盐分的食物,血常规,血管造影,。
 6
6

 5
5

 6
6
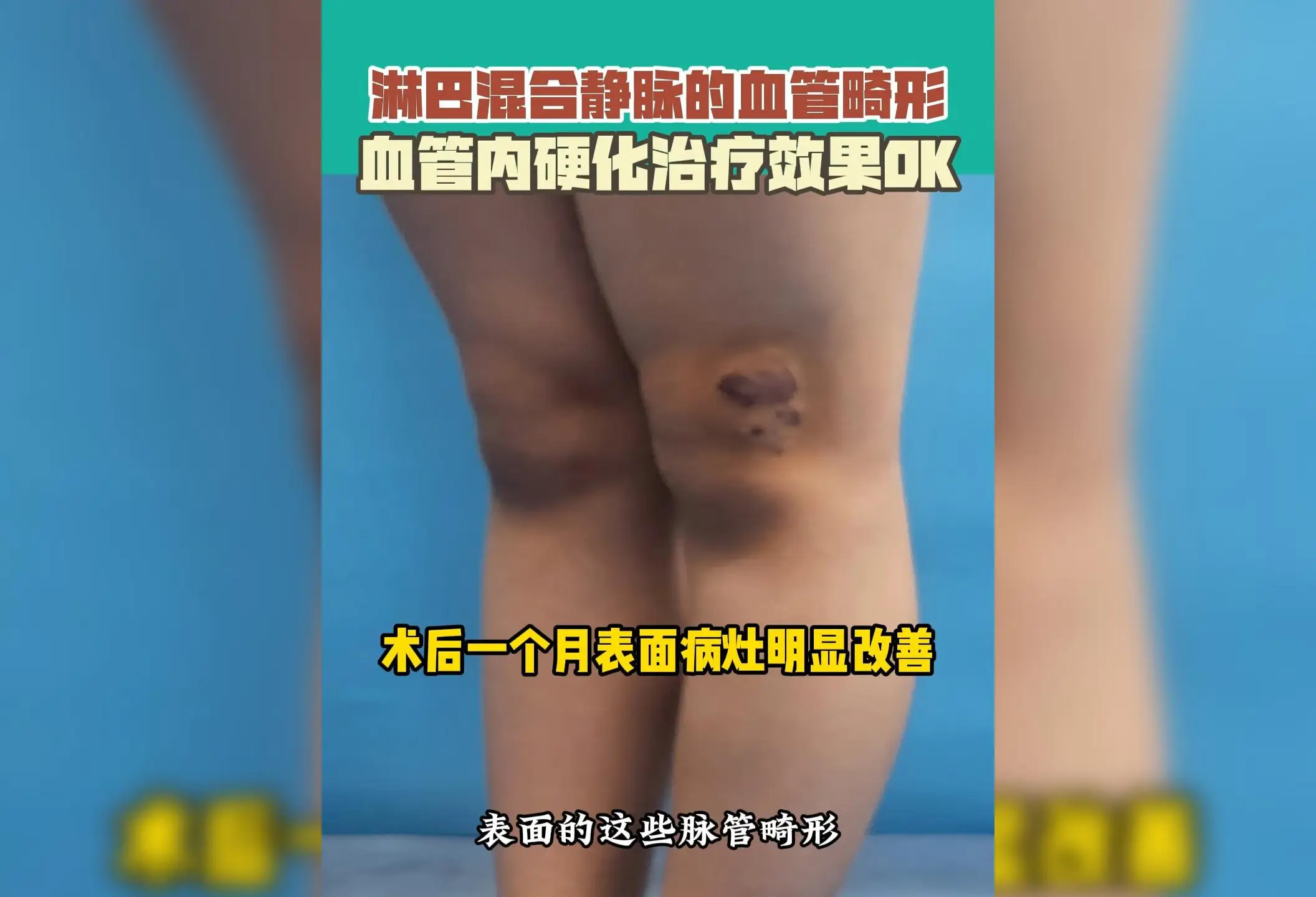
 8
8
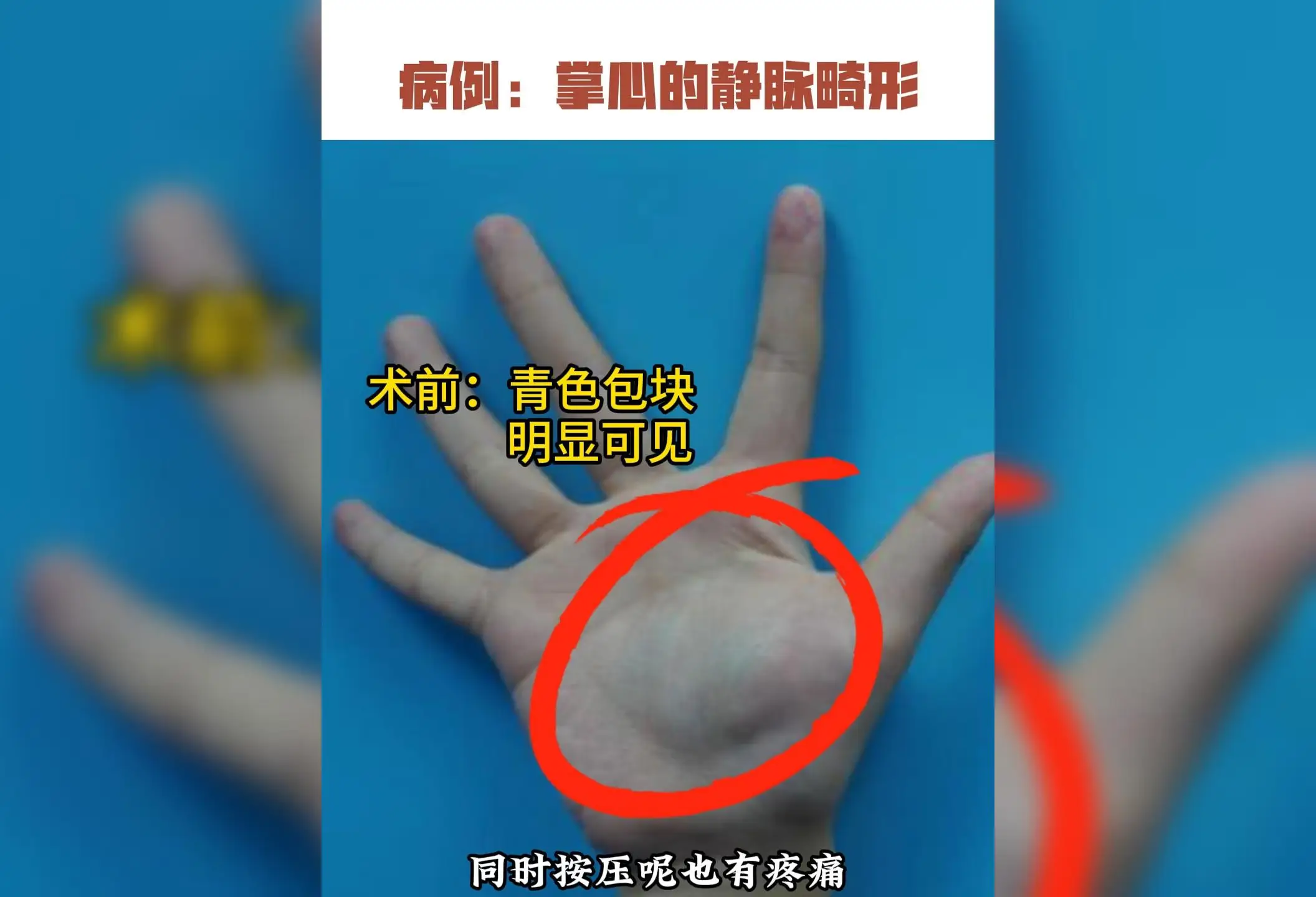
 3
3
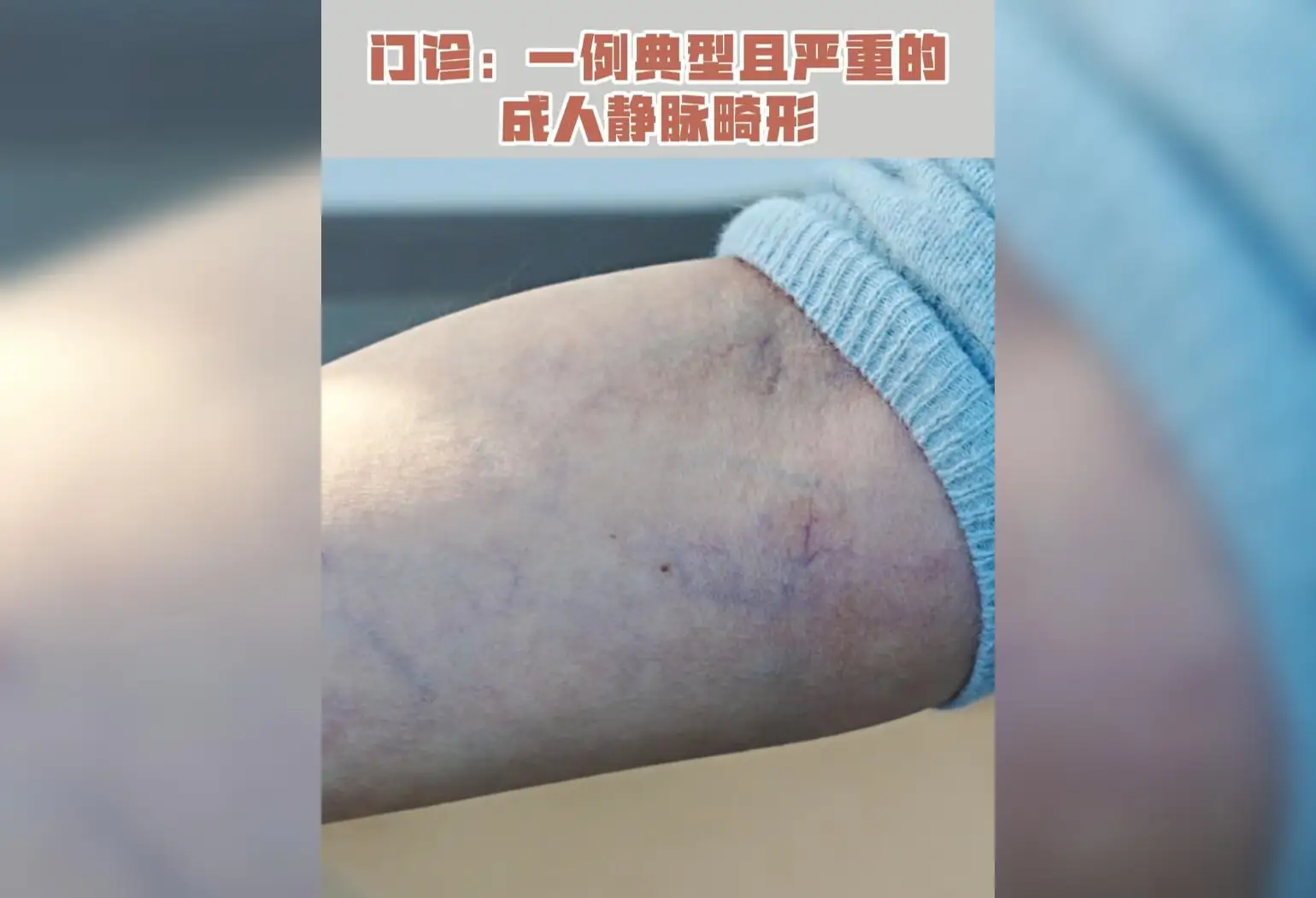
 7
7

 9
9

 0
0

 0
0

 0
0
