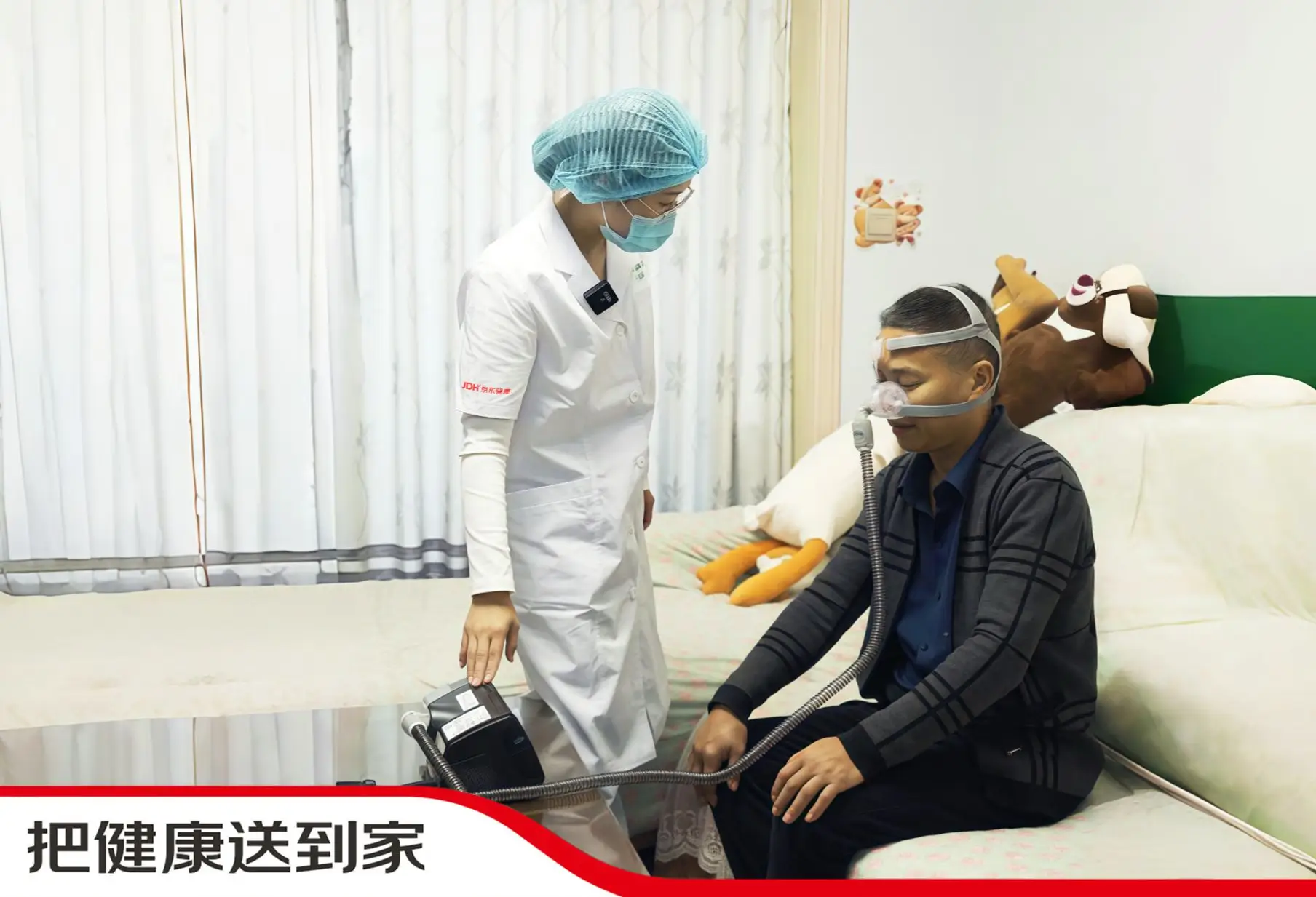
京东健康互联网医院
京东健康互联网医院
 网站导航
网站导航
涿州市医院是集医疗、教学、科研、预防、康复为一体的大型三级甲等综合性医院,是301涿州合作医院、国家药物临床实验机构、河北省住院医师规范化培训基地,是涿州市120急救中心。 医院位于河北省涿州市范阳西路129号,占地面积6.66万平方米,建筑面积22万平方米。 全院共开放床位2600张,设有临床、医技科室近60个。 一、历史沿革 涿州市医院始建于1950年,2004年经政府主导改制成股份制非盈利性医院,属公益性事业单位。2010年4月1日与中国人民解放军总医院(301)签订了军民共建协议,挂牌“中国人民解放军总医院(301)涿州合作医院”。 二、学科建设和学术水平 医院技术力量雄厚,科室专业齐全,现有专业技术人员1732名,其中高级专业技术人员373名,医学博士及硕士52名。 医院依托解放军总医院先进的管理经验、强大的技术支持开展医疗活动,并与多个国家和地区医学院校、医疗科研单位开展了广泛的学术交流和技术合作,每年有70余名技术人员去国内、国外医院进修学习,有50余名外院专家来院访问、讲学和技术指导,医院先后聘请了17名国内著名专家担任技术顾问。目前医院已开展的冠状动脉搭桥术、冠状动脉支架置入术、心律失常射频消融术、颅内外动脉支架置入及血管畸形栓塞术、肿瘤的生物免疫治疗、糖尿病的手术治疗、生殖与整形美容等技术在河北三甲医院中处于中上水平,为广大患者解除了病痛。 三、主要荣誉 医院经过64年的建设,已发展成为技术人才密集、临床学科齐全、设备先进、整体医疗水平较高,在该地区有较高声誉的现代化医院,并成为了: 国家爱婴医院 国家药物临床实验机构 辽宁医学院教学医院 山西医科大学教学医院 河北大学教学医院 河北大学附属医院涿州市医院 河北省住院医师规范化培训基地 河北省职业卫生健康检查定点医院 河北省(省本级)工伤保险医疗服务定点医院 涿州市城镇职工基本医疗保险定点医院 涿州市城镇居民基本医疗保险定点医院 涿州市新型农村合作医疗保险定点医院 涿州市工伤医疗保险定点医院 涿州市一至六级残疾军人医疗保险定点医院 涿州市老年人定点医院。 四、医院科室 临床科室: 神经内科、心血管内科、呼吸科、小儿内科、新生儿科、消化内科、肿瘤科、肾内科、透析科、感染科、内分泌科、中医科、重症医学科、普通外科、神经外科、妇科、产科、骨科、泌尿外科、胸外科、心血管外科、耳鼻咽喉科、眼科、口腔科、皮肤科、急诊科、麻醉科、疼痛科、整形美容科、生殖医学科、血液病科。 医技科室: 手术室、检验科、输血科、功能科、影像科、放疗科、导管室、病理科、药剂科、营养科、保健科、康复医学科、高压氧、体检科、供应室、病案室、门诊部、120急救中心。 五、领导团队 主要领导 院长:韩联合 副院长:崔会专戴富林 机构设置; 医院领导下面管理科室三个部门,分别是:医务处、办公室和护理部,有23个职能部门。 六、合作共赢开拓发展 为方便广大患者能享受到国内一流专家的诊疗服务,该院与301合作,由专家做科室带头人,每周有301专家来院出专科门诊,定期不定期开展业务查房、学术讲座,并建立了远程医学中心,使患者在该院就能享受301专家的会诊咨询,初步达到了“看病不用去北京、301专家来看您”。2014年该院再次与解放军总医院合作投资62亿人民币建立质子治疗中心(五级机房、设1000张床位、全球最大),是解放军总医院肿瘤质子治疗研究所和解放军总医院肿瘤实习基地,并设有解放军总医院康复中心、军医学院和外国留学生医学院,是亚洲首台(iba)的质子治疗科研中心。该项目由省政府划拨1800亩土地建在涿州,距北京43公里、距首都二机场17公里,有机场、轻轨、高速等交通便利,方便患者。此项目土建已开工,质子设备已与iba公司签订协议并付第一笔款,2015年机器设备到位,预计2016年开始运作治疗患者,介时全国及亚洲的肿瘤患者就有了全球最新的治疗手段。利用笔形束扫描和锥形束技术成像,适用所有肿瘤患者,不再用外科手段只需56秒一次、十几次一个疗程、无感、无痛达到治疗效果,解决了肿瘤人的痛苦,全国的肿瘤医生及科研又提高了很大一步,达到了世界最高水平,运行后将成为全球治疗与科研最大、最全的中心。男性乳腺增生称为男性乳房发育症。好发于青春期前后及老年期,病理表现为腺管增生而无腺泡增生,一般可分为原发性和继发性两大类,通常以青春期男孩和老年男子为多,,0,乳房,主要采用激素对抗治疗及手术摘除,乳腺癌,平时应戒烟酒,饮食上不宜过食油腻辛辣之品,激素水平检测性腺激素,影像学检查,。
 12
12

 33
33

 217
217

 18
18
 0
0

 0
0

 0
0

 0
0

 0
0

 0
0