2024年9月19日,强生宣布埃万妥单抗与标准化疗(卡铂和培美曲塞)联合治疗获批FDA[1],适应证为患有表皮生长因子受体(EGFR)19号外显子缺失(ex19del)或L858R替代突变的局部晚期/转移性非小细胞肺癌(NSCLC)成年患者,且这些患者在已接受/接受过 EGFR 酪氨酸激酶抑制剂 (TKI) 治疗期间。
这项获批基于MARIPOSA-2 研究,据强生官网报道,这也是今年获批的第四个适应证。
MARIPOSA-2 研究是一项开放标签、随机Ⅲ期研究,研究的主要目的是评估在奥希替尼治疗失败后的局部晚期或转移性表皮生长因子受体(EGFR)外显子 19 缺失(Exon 19del)或L858R 替代型非NSCLC患者中,埃万妥单抗与标准化疗的疗效。研究的主要结果包括无进展生存期(PFS)[2]。
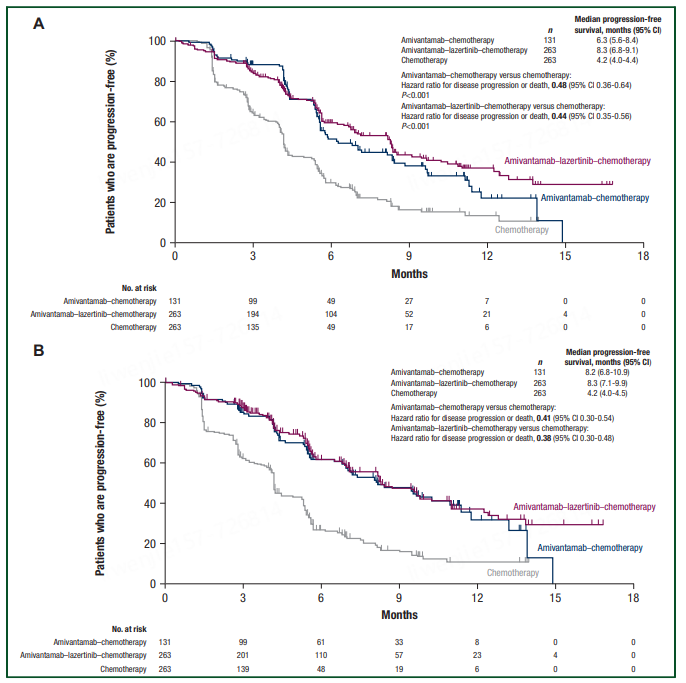
从研究结果来看,与单独化疗相比,埃万妥单抗联合化疗将疾病进展或死亡的风险(无进展生存期 [PFS])降低了 52%。且接受埃万妥单抗联合化疗的患者的中位 PFS 为 6.3 个月,而单独化疗的患者为 4.2 个月。此外,埃万妥单抗组的确认总缓解率 (ORR) 为 53%,而单独化疗为 29%[3]。埃万妥单抗联合化疗也被纳入NCCN指南[1]。
再回归到这个药物本身,埃万妥单抗是一种双特异性抗体,可与肿瘤细胞表面的EGFR和MET的结构域结合,进而通过抗体依赖性细胞毒性 (ADCC) 和胞吞作用机制分别靶向这些细胞,以被免疫效应细胞(如自然杀伤细胞和巨噬细胞)破坏[4]。目前FDA更新的说明书种,其适应证包括:
1.1 表皮生长因子受体(EGFR)外显子 19 缺失或外显子 21 L858R 替代突变的非小细胞肺癌(NSCLC)的一线治疗
1.2 表皮生长因子受体(EGFR)外显子 20 插入突变的非小细胞肺癌(NSCLC)的一线治疗
经 FDA 批准的检测方法检测,RYBREVANT 适用于与卡铂和培美曲塞联合,用于患有表皮生长因子受体(EGFR)外显子 20 插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成年患者的一线治疗。
1.3 既往接受过治疗的表皮生长因子受体(EGFR)外显子 20 插入突变的非小细胞肺癌(NSCLC)。
此外,应用该药时还要注意下列事项:
输液相关反应
该药可引发输液相关反应(IRR);输液相关反应的体征和症状包括呼吸困难、潮红、发热、寒颤、恶心、胸部不适、低血压和呕吐。输液相关反应发作的中位时间约为1小时。
间质性肺病/肺炎
该药可导致严重且致命的间质性肺病(ILD)/肺炎。
同时使用该药和拉泽替尼(Lazertinib)时的静脉血栓栓塞(VTE)事件
该药与拉泽替尼联合使用可引发严重且致命的静脉血栓栓塞(VTE)事件,包括深静脉血栓形成和肺栓塞。这些事件大多发生在治疗的前四个月内。
皮肤不良反应
该药可引起严重皮疹,包括中毒性表皮坏死松解症(TEN)、痤疮样皮炎、瘙痒和皮肤干燥。
眼毒性
该药可导致眼毒性,包括角膜炎、睑缘炎、干眼症状、结膜发红、视力模糊、视力损害、眼痒、眼部瘙痒和葡萄膜炎。
胚胎 - 胎儿毒性
基于其作用机制和动物模型的研究结果,该药用于孕妇时可能对胎儿造成伤害。将其他表皮生长因子受体(EGFR)抑制剂分子用于怀孕动物时,已导致胚胎 - 胎儿发育受损、胚胎致死和流产的发生率增加。告知有生育潜力的女性胎儿面临的潜在风险。建议有生育潜力的女性患者在接受该药治疗期间以及最后一剂该药用药后3个月内采取有效的避孕措施。
最后再来看一下公司信息:强生公司成立于1886年,是全球最具综合性、业务分布范围广的医疗健康产品企业之一,业务覆盖医疗科技和创新制药,总部位于美国新泽西州新布仑兹维克市。2023年,强生顺利完成消费者健康业务分拆,并宣布品牌焕新,将旗下医疗科技和创新制药两大业务整合至强生名下,开启百年强生的崭新征程。
参考文献:
1.RYBREVANT®(amivantamab-vmjw) plus standard of care approved in the U.S. as first and only targeted regimen to cut risk of disease progression by more than half in second-line EGFR-mutated advanced lung cancer
2.A Study of Amivantamab and Lazertinib in Combination With Platinum-Based Chemotherapy Compared With Platinum-Based Chemotherapy in Patients With Epidermal Growth Factor Receptor (EGFR)-Mutated Locally Advanced or Metastatic Non- Small Cell Lung Cancer After Osimertinib Failure (MARIPOSA-2)
3.Passaro A, Wang J, et al; MARIPOSA-2 Investigators. Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study. Ann Oncol. 2024 Jan;35(1):77-90. doi: 10.1016/j.annonc.2023.10.117. Epub 2023 Oct 23. PMID: 37879444.
4.Product Information:RYBREVANT- amivantamab injection,Janssen Biotech, Inc.Updated August 23, 2024
 京东健康互联网医院
京东健康互联网医院
 网站导航
网站导航
 3
3

 8
8

 15
15
 7
7

 27
27

 11
11
 14
14

 12
12

 6
6

 11
11
