简称:
郭金如内科诊所是卫生健康局批准的合格的个体诊所,现有医疗专业人员三名,主要治疗消化系统疾病,心血管疾病,泌尿系统疾病,颈肩腰腿疼。诊所宗旨,患者至上,对待患者就像对自己亲人一样。
-

根据世界卫生组织报告,2018年有210万例新发肺癌病例,其中土耳其、日本、中国、美国和英国的发病率最高。肺癌是一组异质性肿瘤,分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)。包括50多种不同的组织学亚型,例如,NSCLC又分为腺癌、鳞状细胞癌和大细胞癌。
近年来,肺癌治疗取得了相当大的进展,最初仅限于细胞毒化疗。化疗药物阻断细胞周期,攻击快速分裂的细胞。这种传统的治疗方法特异性较低,既会攻击正常细胞,也会攻击癌细胞,导致显著的副作用。癌症治疗的最新进展包括靶向治疗,这种药物可以阻断仅在肿瘤细胞中过度表达或过度活跃的特定分子。靶向治疗大致有三种类型:单克隆抗体、小分子抑制剂和免疫毒素。
肺癌治疗的突破主要体现在患者5年生存率的提高上,从20世纪70年代早期的10.7%上升至21世纪10年代的19.8%。然而,仍然存在一些挑战,如发现新的驱动基因改变,了解耐药机制,发现新疗法的疗效预测因子。NSCLC约占所有肺癌病例的85%,近年来晚期肺癌的治疗经历了从细胞毒性治疗到靶向治疗的转变,下文将重点关注NSCLC的治疗新靶点。
抗EGFR药物
表皮生长因子受体(EGFR)基因是NSCLC的主要驱动基因之一。2016年的一项荟萃分析发现,约32.3%的NSCLC肿瘤存在EGFR基因突变。这种突变在女性中(比男性高19.7%)、亚洲人(比北美人群高52%)、非吸烟者(比过去或者当前吸烟者高27.8%)和腺癌患者中(比其他组织类型高26.3%)更为常见。
抗EGFR治疗包括酪氨酸激酶抑制剂(TKI),是结合EGFR受体的靶向药物。第一代药物以可逆的方式与EGFR的ATP位点结合并抑制磷酸化,阻断EGFR相关的信号通路。第二代TKI通过引起EGFR的催化结构域的共价修饰,不可逆地阻断了该蛋白的酪氨酸激酶活性。第一代TKI包括厄洛替尼、吉非替尼和埃克替尼;第二代TKI包括阿法替尼和达克替尼。各种III期临床试验均显示出,晚期NSCLC中第一代和第二代TKI相比铂类化疗的益处。
第一代和第二代TKI的疗效取决于EGFR所携带的突变。大约70%的EGFR突变肿瘤对TKI有临床反应;剩下的30%对TKI药物一开始就耐药(称为原发耐药),对TKI治疗没有反应,与EGFR外显子20复制或其他突变有关,如PTEN和PIK3CA。尽管有良好的结果,第一代和第二代TKI有相当大的毒性。这些药物可能引起诸如口腔炎、腹泻、皮疹和甲沟炎等副作用,约40%的人群需要降低剂量。
靶向T790M的药物
为克服T790M导致的耐药,奥西替尼、美雷替尼和rociletinib等第三代TKI药物应运而生。这些药物不可逆地与T790M突变的EGFR蛋白高效结合,有效抑制癌症生长,第三代TKI的毒副作用更少。III期AURA研究发现,与NSCLC的标准化疗相比,奥西替尼的PFS增加了5.7个月,疾病控制率(DCR)增加了19%。FLAVUR 的 III期研究比较了奥西替尼和第一代TKI,发现PFS有所增加,从10.2个月延长到18.9个月。
ALK抑制剂
在NSCLC患者中,间变性淋巴瘤激酶(ALK)基因突变也是是药物治疗的常见靶点,约有5%的患者存在这种突变。克唑替尼是一种ALK抑制剂,在一项开放标签的3期临床试验中,针对ALK阳性晚期NSCLC的一线治疗,对克唑替尼与标准化疗的疗效进行了比较。结果显示,与化疗组相比,克唑替尼组的PFS明显更长(10.9个月vs. 7.0个月),然而,中位总生存期却没有显示出显著优势。克唑替尼组有恶心、疲劳、呕吐、食欲减退等不良反应。III期PROFILE 1014试验,也比较了克唑替尼与化疗作为ALK阳性NSCLC患者的一线治疗方案的疗效。克唑替尼每天两次,每次250mg;化疗组给予培美曲塞500 mg/m2 +顺铂75/m2或卡铂静脉注射,每3周一次,最多6个周期。结果显示,克唑替尼组的中位总生存期尚未达到,而常规化疗组的中位总生存期为47.5个月。
阿来替尼是一种高选择性ALK抑制剂。在一项随机、开放标签的3期临床试验中,研究者比较了阿来替尼(600mg,每日2次)和克唑替尼(250mg,每日2次)对ALK阳性NSCLC患者的疗效。结果显示阿来替尼组的PFS率较高(68.4% vs. 48.7%)。与克唑替尼相比,阿来替尼组的3级或5级不良事件更少(41% vs 50%)。
一项随机III期试验招募了303名以前未接受过化疗的患者,接受阿来替尼(600mg,每日两次)或克唑替尼(250mg,每日两次)治疗。在中位随访17.6个月(克唑替尼)和18.6个月(阿来替尼)期间,阿来替尼组和克唑替尼组疾病进展发生率分别为41%和68%。在阿来替尼组中有82.9%的患者有缓解,克唑替尼为75.5%。阿来替尼组3 - 5级不良事件发生率较低(41 vs 50%)。
c-MET抑制剂
c-MET蛋白是NSCLC进展的另一个关键因素,使其成为新的希望靶点。靶向c-MET激活机制的药物是治疗NSCLC的重要手段,这些药物包括MET酪氨酸激酶活性抑制剂(克唑替尼,特泊替尼,卡马替尼),针对MET(奥那妥组单抗)或HGF (利妥木单抗)的单克隆抗体。
AcSe II期试验发现,克唑替尼用于MET突变患者的ORR为36%,MET扩增患者的ORR为32%。METROS II期试验发现,接受克唑替尼治疗的MET突变或扩增患者的中位ORR为27%,PFS为4.4个月。
对卡马替尼的试验显示了更有希望的结果。卡马替尼主要靶向扩增和第14外显子突变的MET。GEOMETRY Mono-1试验研究了卡马替尼在晚期NSCLC中的疗效,结果显示ORR为71.4%,缓解持续时间为8.41个月。该研究还发现,与之前治疗的患者相比,既往未治疗过的患者PFS高了近4个月。
在对MET扩增和EGFR突变患者进行分析的II期JO28638试验中,与厄洛替尼相比,奥那妥珠单抗的ORR为68.9%,PFS为8.5个月。另一项对奥那妥珠单抗+贝伐珠单抗+培美曲塞进行的研究发现,加用奥那妥珠单抗并不能带来益处,只会增加不良反应的发生率,如外周水肿和血栓栓塞。抗HGF抗体利妥木单抗的研究中,显示DCR为60%,PFS为2.6个月。
参考文献:
J Clin Med. 2020;9(11): 3543.京东健康互联网医院医学中心
作者:卢秀玲,毕业自北京大学公共卫生学院,曾在某知名医学网站担任医学总编辑,负责过肿瘤、心血管、内分泌等多个频道的内容产出。
-

随着过去10年免疫检查点抑制剂在临床上的成功,人们对癌症的免疫疗法产生了极大的兴趣。免疫检查点抑制剂的重要性不言而喻,2018年诺贝尔生理学或医学获奖就授予了研究CTLA-4的James Allison教授和研究PD-1的Tasuku Honjo教授。
免疫检查点抑制剂对黑色素瘤,非小细胞肺癌,头颈部鳞状细胞癌,肾细胞癌,霍奇金淋巴瘤,尿路上皮癌,胃癌,原发性纵隔B细胞淋巴瘤,默克尔细胞癌,肝细胞癌和宫颈癌都有效。然而,即使在免疫应答型的肿瘤中,大多数患者也没有持久的疾病缓解能力。对于许多肿瘤类型,免疫检查点抑制剂单药治疗无效。因此,可预测免疫疗法和联合疗法效果的生物学标志物引起了众多研究者的兴趣。
近日,著名医学期刊《Lancet》刊登了一篇综述,总结了免疫治疗与化疗、靶向治疗、放射治疗和其他免疫调节剂的联合治疗进展,分析了选择治疗方案和制定联合治疗策略的临床考虑。

图源:《Lancet》官网
联合化疗
化疗诱导癌细胞死亡可以促进肿瘤抗原释放和抗原递呈,并刺激免疫效应。肿瘤体积的减少不仅可以让免疫疗法有更多的时间发挥作用,还可以降低产生抗性克隆的可能性。在非小细胞肺癌、小细胞肺癌和三阴性乳腺癌中,免疫检查点抑制剂+标准化疗已取得了成功。然而,在三阴性乳腺癌中,仅在肿瘤浸润免疫细胞具有PD-L1表达的患者中, 阿特珠单抗显示出了增强白蛋白结合型紫杉醇的抗肿瘤疗效。
免疫治疗与抗体药物偶联物(ADC)的联合也在探索中。在HER2阳性和雌激素受体阳性的乳腺癌患者中,以HER2为靶点的ADC药物T-DM1与分散在肿瘤间质中的肿瘤浸润淋巴细胞显著增加有关。在原位HER2阳性模型中,T细胞耗竭降低了T-DM1治疗小鼠的总体存活率,提示免疫应答对T-DM1的疗效至关重要。基于这些数据,一些针对ADC的研究正在探索与免疫治疗相结合的用药策略。
联合靶向治疗
在过去的5年里,抗PD-1或抗PD-L1抗体治疗+靶向治疗已被广泛研究。一个基本目标是,联合用药应该比连续给药更有效,但要注意联合用药通常比单一疗法会产生更多的副作用。
两个显著的成功案例是抗PD-1药物派姆单抗+阿西替尼(血管内皮生长因子[VEGF]受体酪氨酸激酶抑制剂)以及阿西替尼+抗PD-L1药物阿维鲁单抗用于晚期肾细胞癌的治疗。 两种联合用药都比单一使用标准治疗药物舒尼替尼更有效,因此,这两种联合用药策略都被监管机构所批准。
联合放疗
目前有超过100项试验正在检查放疗联合免疫治疗或放射免疫偶联物的疗效。放疗可以通过肿瘤抗原的释放、I型干扰素感应、和改良的免疫抑制肿瘤微环境来促进免疫,形成对非辐照损伤的远位效应,这是放射免疫治疗的基本原理。有一些早期的研究表明,放疗和CTLA-4抑制剂在化疗难治性非小细胞肺癌中,可诱导全身抗肿瘤T细胞,放疗后血清干扰素β升高和T细胞克隆的早期变化是最有力的应答预测因子。
PEMBRO-RT的II期随机试验显示,仅使用免疫检查点抑制剂12周的应答率为18%,而立体定向放疗后再使用免疫检查点抑制剂12周应答率为36%。尽管该研究未达到预定的疗效终点,但在PD-L1阴性亚组中观察到无进展生存期和总体生存期的获益,这表明立体定向放射疗法可有效治疗冷肿瘤。然而,最佳放疗策略尚未确定。有初步研究表明,低剂量放疗可能是另一种增强检查点抑制剂应答的策略。
与其他免疫调节剂联用
抗PD-1抗体和CTLA-4抑制剂联合使用增加了黑色素瘤、肾细胞癌和高度微卫星不稳定(MSI)结直肠癌的持久应答。在一项III期临床试验中,与伊匹单抗(19%)或纳武单抗(44%)单药治疗相比,纳武单抗+伊匹单抗联合治疗的晚期黑色素瘤患者,有更高的应答率(57%)。这一结果推动了这种用药组合对其他更多类型肿瘤的研究。
PD-1/PD-L1与其他药物的联用也在积极研究中,如LAG3抑制剂,TIM-3抑制剂,T细胞活化V结构域Ig抑制剂和TIGIT。在一项II期试验中,有报道称在阿特珠单抗的基础上加用TIGIT抗体替瑞利尤单抗可以增强PD-L1阳性的非小细胞肺癌患者的疗效,但其效果仅限于高PD-L1(肿瘤比例评分[TPS]≥50%)的患者。
联合治疗的副作用
联合用药可能提高疗效,但也可能增强毒性。例如,在CheckMate 067试验中,对晚期黑色素瘤患者进行了研究,结果显示59%接受纳武单抗+伊匹单抗的患者、23%接受纳武单的患者和28%接受伊匹单抗的患者报告了与治疗相关的3-4级不良事件。因此,在决定是采用单一治疗还是联合治疗时,应考虑相关毒性。
在设计新的联合疗法时,毒性是一个重要的问题。不是所有已批准药物都可以安全地与免疫治疗联合。例如,维罗非尼不能与伊匹单抗联合使用,因为有报道称维罗非尼会产生肝毒性效应。维罗非尼+考比替尼+阿特珠单抗的联合使用导致了较多但可控的毒性。在IMspire150试验中,治疗相关的3级或4级不良事件发生率在阿特珠单抗+维罗非尼+考比替尼的患者中为79%(182/230),在安慰剂+维罗非尼+考比替尼的对照组患者中为73%(205/281)。然而,目前尚不清楚联合用药的疗效是否优于依次用药,以及疗效的更优是否意味着毒性的增加。
其他临床考虑
一个重要的问题是,是否应在治疗早期采用联合疗法。在对免疫检查点抑制剂有反应的患者中,大多数试验在单药治疗失败后再开始联合用药,这种方法有三个主要缺点。首先,联合疗法可能对未做免疫治疗的患者有疗效,但不能增强免疫治疗耐药患者的疗效。第二,随着治疗线的增加,免疫治疗的疗效会降低。最后,一些患者可能存在不可逆转的耐药机制(如抗原递呈丧失)。另一种方法是从一开始就开始联合治疗。然而,这种方法将使对单一疗法就有反应的患者暴露在不必要的毒性环境中。需要进行详细的研究来确定联合治疗的时机(例如,疾病开始时vs进展时,或在长期稳定后),以及每种疗法对哪些患者有获益。
参考文献:
Lancet. 2020 Dec 4;S0140-6736(20)32598-8.
京东互联网医院医学中心
作者:梁辰,约翰霍普金斯大学公共卫生学院流行病学硕士,主要研究方向为慢性病流行病学。
-
免疫疗法,主要是靶向PD-1或PD-L1的免疫检查点抑制剂,已成为大多数晚期肺癌患者的标准治疗方法,与化疗相比具有生存优势,且副作用更低。在短短的时间内,PD-1和PD-L1抑制剂已经从一种有希望的挽救性疗法,变为晚期非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)的标准一线治疗策略,是局部晚期不可切除NSCLC的重要治疗手段,也是早期NSCLC的一种潜在治疗策略。下文总结了免疫疗法在转移性非小细胞肺癌一线治疗中的应用。
PD-1/PD-L1单药用于转移性NSCLC一线治疗
KEYNOTE-024试验是首个建立了免疫治疗可用于NSCLC一线治疗的研究。这项全球性III期试验纳入了305例PD-L1高表达的IV期NSCLC患者,患者被1:1随机分配至派姆单抗或铂类化疗。中位随访时间为11.2个月,派姆单抗组的中位无进展生存期(PFS)为10.3个月,明显高于化疗组的6.0个月。KEYNOTE-024证明了 在PD-L1高表达的转移性NSCLC患者中,一线治疗使用派姆单抗比化疗更有生存优势,FDA于2016年批准了该适应症。
IMpower 110试验探讨了阿特珠单抗在PD-L1阳性NSCLC患者一线治疗中的作用。这项III期试验纳入了572名患者,被1:1随机分配到阿特珠单抗组或化疗组。中位随访15.7个月,在PD-L1高表达人群中,阿特珠单抗组的表现优于化疗,阿特珠单抗组的中位总生存期(OS)为20.2个月,化疗组为13.1个月。 2020年5月,FDA批准阿特珠单抗用于PD-L1高表达晚期NSCLC患者的一线治疗。
双免疫检查点抑制剂用于转移性NSCLC的一线治疗
除了PD-1/PD-L1抑制剂外,另一种成功的免疫检查点抑制剂是CTLA-4抑制剂,如伊匹单抗是黑色素瘤和肾细胞癌的标准治疗组成。基于CheckMate 227试验显示出的疗效,也已成为NSCLC的标准一线治疗选择。
CheckMate 227试验纳入了既往未治疗过的NSCLC患者。1189名表达PD-L1的患者被随机分配至联合免疫治疗(纳武单抗 3mg/kg,伊匹单抗1mg/kg),纳武单抗单药治疗(240 mg),或铂类化疗。550名无PD-L1表达的患者,随机接受纳武单抗+伊匹单抗治疗,纳武单抗(360mg)联合化疗,或铂类化疗。
在PD-L1阳性组中,联合免疫治疗组优于化疗组,中位OS分别为17.1个月和14.9个月。 2020年5月15日,纳武单抗+伊匹单抗联合治疗被FDA批准用于PD-L1阳性晚期NSCLC的一线治疗。
化疗+免疫治疗用于晚期非鳞状NSCLC的一线治疗
另一种在肺癌治疗中获得成功的免疫治疗策略是将 PD(L)1抑制剂与化疗联合使用,这种策略对PD-L1阴性肿瘤也有效。目前已有许多组合被发现有效,化疗+免疫疗法策略已被证明有效且耐受性良好。
第一个被批准的肺癌化疗-免疫治疗方案是基于KEYNOTE-021G试验,该研究探讨了铂类化疗加上派姆单抗的疗效。在这项随机II期研究中,123例未经治疗的EGFR和ALK野生型、非鳞状NSCLC患者被随机分配到卡铂加培美曲塞组或化疗加派姆单抗组。结果显示,卡铂和培美曲塞的基础上加入派姆单抗可改善患者缓解率(58% vs. 33%)、PFS(24.5 vs. 9.9个月)和OS(34.5 vs. 21.1个月)。 派姆单抗+卡铂和培美曲塞方案于2017年5月10日获得FDA加速审批。
该方案的确证性III期试验为KEYNOTE-189,该研究以2:1的方式将616名既往未经治疗、EGFR和ALK野生型、非鳞状NSCLC患者随机分配至每3周一次的派姆单抗 200 mg组或安慰剂组,并加上4个周期的顺铂或卡铂加培美曲塞。中位随访23.1个月的结果显示,一线治疗中派姆单抗联合化疗改善了患者的生存率,卡铂+培美曲塞+派姆单抗的中位OS为22.0个月,化疗+安慰剂为10.7个月。基于该研究, FDA于2018年8月20日批准派姆单抗+铂类+培美曲塞用于非鳞状NSCLC的一线治疗。
一线化疗加上阿特珠单抗,也能改善患者结局。在IMpower 130试验中,724例既往未治疗的晚期非鳞状NSCLC患者以2:1的比例被随机分配至阿特珠单抗(1200mg)或安慰剂组,同时给予卡铂和白蛋白紫杉醇。中位随访18.5个月,阿特珠单抗组的生存期更好,中位OS为18.6个月,安慰剂组为13.9个月。 阿特珠单抗联合卡铂+白蛋白紫杉醇于2019年12月3日获得FDA批准。
另一个引人注目的免疫治疗策略是 化疗-免疫治疗再加上血管生成抑制剂。IMpower 150试验探讨了一线化疗中加入贝伐珠单抗和阿特珠单抗的疗效。既往未接受过治疗的非鳞状NSCLC患者接受四个周期的卡铂和紫杉醇治疗,并随机1:1:1接受贝伐珠单抗单药、阿特珠单抗单药或贝伐单抗联合阿特珠单抗。
结果显示,阿特珠单抗、贝伐珠单抗、卡铂和紫杉醇4药方案组的中位PFS为8.3个月,OS为19.2个月,优于贝伐珠单抗+卡铂+紫杉醇组(中位PFS为6.8个月,中位OS为14.7个月)。与其他研究类似,该方案在不同PD-L1表达水平的患者中均有获益。 阿特珠单抗+贝伐珠单抗+卡铂+紫杉醇的方案于2018年12月6日获得FDA批准,作为晚期非鳞状NSCLC的一线治疗策略。
化疗+免疫治疗用于晚期鳞状NSCLC的一线治疗
化疗+免疫治疗也能改善鳞状NSCLC患者的结局。KEYNOTE-407试验将559例未经治疗的鳞状NSCLC患者随机分配至派姆单抗或安慰剂组,并同时给予化疗(卡铂加紫杉醇或白蛋白紫杉醇)。结果显示,化疗基础上加入派姆单抗改善了患者生存期,中位OS为15.9个月,单纯化疗组为11.3个月,在不同PD-L1表达水平的患者中均有获益。 派姆单抗联合卡铂和紫杉醇或白蛋白紫杉醇于2018年10月30日被FDA批准为晚期鳞状NSCLC患者的一线治疗方案。
然而,研究显示, 卡铂和白蛋白紫杉醇基础上加用阿特珠单抗并不能改善鳞状NSCLC患者的总生存。在IMpower 131试验中,未经治疗的晚期鳞状NSCLC患者被1:1:1随机分配至卡铂和白蛋白紫杉醇加阿特珠单抗组,卡铂和紫杉醇加阿特珠单抗组,或卡铂和白蛋白紫杉醇组。结果显示,加上阿特珠单抗后PFS有所改善,但对总生存期没有改善,加用阿特珠单抗的中位OS为14.2个月,单纯化疗组为13.5个月。
参考文献:
J Surg Oncol. 2021 Mar;123(3):718-729.
京东健康互联网医院医学中心
作者:卢秀玲,毕业自北京大学公共卫生学院,曾在某知名医学网站担任医学总编辑,负责过肿瘤、心血管、内分泌等多个频道的内容产出。
-

健康饮食就是既要吃得好,又吃得适量,均衡饮食,是结合自身身体及外部环境,选择正确的饮食搭配。
在饮食过程中,尽量避开一些油脂量过高的食物。每天的食谱应至少包括牛奶(半斤)、鸡蛋(1个)、豆制品(2两)等三种中的两种。每天都要吃肉(2~3两),鱼和海鲜更好一些,肉类的话,一定要选瘦的,越瘦越健康。另外每餐都要有至少两种以上蔬菜(总量达每天一斤左右),水果每天约半斤。
-
2018年5月份,美国癌症学会(American Cancer Society, ACS)发布了一项最新指南[1],推荐意见指出,一般人群从45岁就可以开始结直肠癌的筛查(有条件推荐),50岁以上人群定期筛查结直肠癌是强推荐。指南还指出:① 身体健康、未来预期寿命超过10年的人群,应持续筛查至年龄75岁;② 针对76岁至85岁的人群,临床医生可根据患者意愿、预期寿命、健康状况和既往筛查情况,制定个体化筛查策略;③ 年龄大于85岁的人群,不推荐继续进行结直肠癌筛查。
结直肠癌筛查的方法有:每年进行粪便免疫化学检测;每年进行高灵敏度愈创木脂大便潜血测试;每三年进行一次多靶点粪便DNA检测;每10年进行一次结肠镜检查;每5年进行一次CT结肠造影检查;每5年进行一次柔性乙状结肠镜检查。
ACS新指南引争议
如果按照这个新指南提出的筛查建议,美国可进行结直肠癌筛查的人群数量增加了2200万,指南发布后也引起了关于筛查风险获益以及对医疗资源影响的讨论。
50岁以下人群结直肠癌筛查的直接有效性证据很少,大多数证明结直肠癌筛查益处的随机对照试验(RCT)证据都是针对50岁以上的人群。这次指南更新的内容是基于2017年一项对SEER数据库(注:美国权威的癌症统计数据库)的分析结果[2],显示从2000年到2013年,40-49岁人群结直肠癌(即早发结直肠癌)发病率相对增加了22%,从5.9例/10万人年增加到7.2例/10万人年。虽然看起来数字增加了,但是众多专家对提前筛查年龄持批评态度,因为50岁以下的人群发生结直肠癌的绝对风险依然非常低,而且缺乏支持这个年龄组进行筛查有效的有力证据。
修订后的这一指南建议,并未考虑提早筛查年龄带来的社会成本增加,不论是医疗花费还是医疗资源都会从疾病风险更大的人群中分散出去,疾病风险更大的人群才是筛查的重点对象。
年轻成人结直肠癌风险有多高?
在上述背景下,《Annals of Internal Medicine》(内科学年鉴)期刊上近期发布了一项新报告[3],对SEER数据库进行一次更新、更全面的分析,描述了年轻成人的结直肠癌风险,包括20-29岁、30-39岁、40-49岁以及50-54岁年龄组的人群。
2017年的SEER数据库研究将“结直肠癌”作为一个整体,而在近期的这项报告中,作者将结直肠癌腺癌(筛查的主要类型)和其他组织学类型的结直肠癌分割开来,后者包括神经内分泌肿瘤(类癌)(不推荐对这个类型进行筛查)。新报告的分析表明,既往研究中提到的结直肠癌,4%到20%不是腺癌,而是类癌。既往研究中早发结直肠癌中发病率增幅最大的部分,即直肠癌,多达34%是类癌而并非腺癌。
针对癌症预防性干预措施(如癌症筛查)的指南建议,应基于癌症绝对风险和筛查后绝对风险降低的数据来制定。这项新报告给出的结果很有价值,因为它阐明了结直肠腺癌的风险要低于ACS指南中估计的风险,基于这项新数据,2018年ACS指南中估计的45岁至49岁结直肠癌新发病例数应下调。
有必要对50岁以下人群进行筛查吗?
40至49岁人群的结直肠癌绝对风险为7.2例/10万人年,约为50至59岁人群的三分之一,60岁及以上人群的十分之一。结肠镜检查相关的30天死亡率估计为3/10万检查。由于没有针对40至49岁人群的临床筛查试验,因此无法量化该年龄组筛查带来的获益,只能基于模型来估算。即使是乐观的情况,假设在40至49岁的人群中进行筛查可将CRC发病率降低达50%,计算一下,每10万例结肠镜检查导致3例死亡的危害,也超过了每10万人年可避免3.6例结直肠癌发生的收益。此外,对45至49岁年龄组筛查的成本也会很高。
正如最新报告指出的那样,类癌不是结直肠癌筛查的目标,但这一发现还值得进一步思考。类癌通常为惰性,比大多数其他癌症类型的预后更好。这项新研究发现,类癌的发病率上升最快的人群是年龄在50至54岁之间的人群,这类人群的筛查已经很普遍了。因此,筛查确定了大多数类癌,代表了多数都是偶然发现的。实际上,很多可能是被过度诊断的肿瘤,这也增加了筛查的负担和危害。
2020年10月,美国预防服务工作组(USPSTF)发布了结直肠癌筛查建议的更新[4],该建议考虑将结直肠癌开始筛查的年龄降低到45岁。自2016年USPSTF指南更新以来,未出现任何新的有力证据可证明50岁以下人群进行筛查的有效性。和2018年ACS指南一样,工作组完全依赖模型估计。上述新报告提供的新数据应促使研究人员重新计算对筛查的益处和危害的估计。
毫无疑问,早发性结直肠癌是一个重要但仍知之甚少的领域。但是,也不应该根据次优数据来制定筛查决策,尤其是当这一建议可能影响数百万人时。ACS在2018年指南中将该建议标记为有条件推荐(B级)。尽管这样看起来比较严谨,但在美国,45至49岁人群的结直肠癌筛查已经增加了50%以上。一些患者不管其推荐强度如何,只会关注指南推荐的内容。许多医疗机构也在不完全了解数据或潜在影响的情况下,迅速遵循了新的指南建议。
结合《Annals of Internal Medicine》新报告的数据,并考虑到基于建模数据制定指南推荐意见的不确定性,在评估50岁以下人群进行结直肠癌筛查的益处时,应格外谨慎。结直肠癌筛查在年轻成人中的功效,仍不确定,要求进行更严格的临床试验,而不是广泛实施指南推荐。
参考文献:
1. CA Cancer J Clin. 2018;68:250-81.
2. CA Cancer J Clin. 2017;67:177-93.
3. Ann Intern Med. 15 December 2020. doi:10.7326/M20-0068
4. U.S. Preventive Services Task Force. Draft recommendation statement. Colorectal cancer: screening.
5. Ann InternMed. doi:10.7326/M20-7244
京东健康互联网医院医学中心
作者:梁辰,约翰霍普金斯大学公共卫生学院流行病学硕士,主要研究方向为慢性病流行病学。
-

糖尿病相关的病理过程,包括胰岛素抵抗进展和β-细胞功能恢复,在青少年发病的2型糖尿病中比在成人2型糖尿病中进展更快。这些因素导致血糖控制不佳,并增加早期糖尿病相关并发症的风险。
青少年糖尿病注册登记研究表明,2型糖尿病患者的糖尿病肾病、高血压、视网膜疾病和周围神经疾病的发病率高于1型糖尿病患者。澳大利亚的一项研究数据显示,2型糖尿病的发病年龄与终末期肾病长期风险存在负相关关系。
由于缺乏前瞻性数据,制定青少年发病的2型糖尿病患者的并发症预防和管理方面遇到了一些瓶颈。对青少年2型糖尿病治疗方案(TODAY)临床试验参与者的纵向随访,积累了糖尿病相关并发症的数据,包括危及生命的终末器官损伤情况。近期,研究者报告了这类患者的长期并发症的发生率,相关结果发表在新英格兰医学杂志上。
这项多中心临床试验从2004年到2011年纳入患者,评估三种治疗方法(二甲双胍、二甲双胍+罗格列酮、二甲双胍+强化生活方式干预)对青少年发病的2型糖尿病患者的影响。试验结束后,参与者进行二甲双胍±胰岛素治疗,并被纳入观察性随访研究(从2011年到2020年),本文就报告了这项随访研究的结果。每年随访时会对糖尿病肾病、高血压、血脂异常和神经疾病进行评估;视网膜疾病进行了两次评估。
临床特征
在研究结束时,从2014年3月到2020年1月接受评估并被纳入分析的500名参与者的平均年龄为 26.4±2.8岁,诊断为糖尿病的平均病程为 1 3.3±1.8年。
研究显示, 糖化血红蛋白水平随着时间推移在增加,糖化血红蛋白水平在非糖尿病范围内(<6%[48mmol/mole])的参与者占比,基线时为75%(即纳入临床试验时),15年时(即随访结束时)为19%。糖化血红蛋白水平至少为10%的参与者比例,在基线时为0%,15年时为34%。
BMI从基线开始上升(在3-9年时达到高峰),随后逐渐下降;总体的BMI中位数仍在35.0-37.5的范围内。研究结束时,参与者正在服用的糖尿病药物仍然主要是胰岛素和二甲双胍,在最后一次随访时,近50%的参与者服用这两种药物;超过四分之一的参与者没有服药。
高血压和血脂异常
基线时高血压的患病率为19.2%, 15年中的累积发病率为67.5%。20.8%的参与者在基线时存在血脂异常, 15年的累计发病率为51.6%。不同的治疗方案组中,高血压或血脂异常的发病率没有差异。
肾脏、神经和视网膜病变
基线时肾脏疾病的患病率为8.0%, 15年的累积发病率为54.8%。基线时,1.0%的参与者有神经疾病, 15年的累计发病率为32.4%。视网膜疾病一共被评估了两次,使得无法确定累积发病率。在第一次评估时(2010年或2011年),13.7%的人有非常轻微的非增殖糖尿病视网膜病变。7年后(2017年或2018年),51.0%的人有眼部疾病,包括8.8%的人有中度至重度视网膜变化,3.5%的人有黄斑水肿。
微血管并发症的累积发病率,在9年时为50.0%,在15年时为80.1%。微血管并发症的危险因素包括少数民族、高糖化血红蛋白水平、低胰岛素敏感性、高血压和血脂异常。不同的治疗方案组中,没有发现显著差异。
整体并发症的情况
在最后一次随访时,677名参与者中的270人(39.9%)没有糖尿病并发症,215人(31.8%)有一个并发症,144人(21.3%)有两个,48人(7.1%)有三个。在单因素分析中,与并发症累积发生风险增加密切相关的因素是 高血糖、高BMI、低胰岛素敏感性、高血压和血脂异常。
不良事件的发生率
所有心脏、血管和脑血管事件的发病率为3.73/1000人年;有17起严重的心血管事件(心肌梗死[4例],充血性心力衰竭[6例],冠状动脉疾病[3例],和卒中[4例])。所有眼部疾病事件的发病率,包括60个晚期事件,为12.17/1000人年。所有肝脏、胰腺或胆囊事件的发病率为6.70/1000人年。所有神经事件的发病率是2.35/1000人年。所有肾脏事件,包括终末期肾脏疾病,发病率为0.44/1000人年。有6例死亡报告(心肌梗死、肾衰竭、药物过量和败血症各1例,败血症并多器官衰竭2例)。
讨论分析
这项前瞻性纵向研究表明, 糖尿病相关并发症在青少年发病的2型糖尿病患者中很早就出现了,而且风险在不断积累;研究中60.1%的参与者至少发生了一种微血管并发症。此外, 28.4%的参与者有两种或以上的糖尿病并发症;在这些参与者中,诊断糖尿病的平均病程为13.3年。尽管参与者的年龄较小,但还是发生了严重的心血管事件。
微血管并发症,包括糖尿病肾病,影响到大约25%的1型糖尿病持续时间超过10年的年轻人。儿童发病的糖尿病并发症流行病学研究显示,1型糖尿病持续时间为25年,糖尿病肾病的累积发病率为32%。
关于2型糖尿病,UKPDS研究显示,10年后中度白蛋白尿的发病率为25%,此后每年发病率增加2%,在最初诊断后25年,糖尿病肾病的累积发生风险估计为55%。在DPP研究中,2型糖尿病成年参与者的复合微血管结局(肾脏、神经和视网膜疾病)的发病率为12.3%-14.4%。
青少年发病的2型糖尿病并发症高发的原因尚不清楚。在这个队列人群中, 并发症的累积风险与高血糖、胰岛素抵抗、高血压和血脂异常密切相关。不幸的是,青少年发病的2型糖尿病对现有疗法的反应并不理想,由于年龄和特有的社会经济因素,在患者依从性和管理方面也面临重大挑战。
FDA批准用于青少年发病的2型糖尿病的药物只有 二甲双胍和胰岛素,最近增加了 GLP1受体激动剂。SGLT2制剂可以改善成人2型糖尿病患者的心血管和肾脏疾病进展,但FDA尚未批准用于青年2型糖尿病, SGLT2抑制剂和GLP1受体激动剂是否会对青少年2型糖尿病患者产生心脏保护和肾脏保护作用尚不清楚。
减重手术是对青少年2型糖尿病患者的一种紧急干预措施,可使大多数患者的体重持久下降,血糖控制得到改善。TODAY研究小组和青少年减肥手术纵向评估(TeenLABS)的联合数据显示,减重手术对血糖和非血糖结果的影响比药物治疗更大。
参考文献:
N Engl J Med. 2021 Jul 29;385(5):416-426.
京东健康互联网医院医学中心
作者:肖靖,2009-2012年就读于301医院内分泌学硕士,2012年毕业后工作于北京博爱医院内分泌科。
-

㊗️大朋友小朋友们新年快乐!兔年大吉!给大家拜年啦!#祝大家2023年兔年大吉 #给大家拜年啦 #新年快乐️兔年大吉 @DOU+小助手
-

降血脂是降低心血管发病率和死亡率最有效的措施之一。通过他汀类药物、依折麦布或蛋白转化酶枯草杆菌蛋白酶/kexin9型抑制剂(PCSK9i)降低低密度脂蛋白(LDL-C)的临床获益已被充分证实。
胆固醇治疗研究者协作组(CTT)通过系统综述的方法评估了他汀类药物降低LDL-C的临床获益1。21篇研究的Meta分析表明:使用他汀类药物可以使LDL-C降低1.07mmol/L,每降低1.0mmol/L LDL-C 可使主要心血管事件降低21% (95% CI 19-23; p<0.0001)。CTT进一步评估了强化他汀治疗的临床效果,结果发现:强化他汀治疗可以在常规治疗的基础上降低LDL-C 0.51mmol/L,每降低1.0mmol/L LDL-C可进一步降低主要心血管事件28%(95% CI 22-34; p<0.0001)(见下图)。
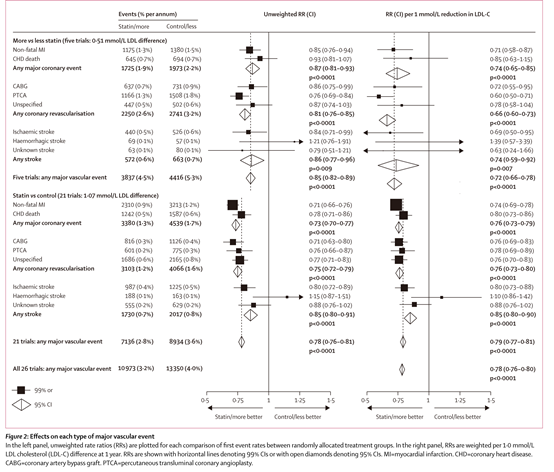
图源:Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials
依折麦布是一种非他汀类的降脂药物,通过靶向作用于 Niemann-Pick C1-like 1 (NPC1L1) 蛋白减少肠道对胆固醇的吸收。在他汀类药物治疗的基础上加用依折麦布可进一步降低 LDL-C 23%-24%。为了考察依折麦布能否能否降低心血管事件,IMPROVE-IT研究2纳入18,144名急性冠脉综合征患者,将其随机分为联合用药组(阿托伐他汀40mg联合依折麦布10mg)和他汀单药治疗组(阿托伐他汀40mg联合安慰剂)。治疗期间,联合用药组LDL-C控制水平为53.7mg/dL,而他汀单药治疗组为69.6 mg/dL。随访7年后,联合用药组主要终点事件发生率为32.7%,而辛伐他汀单药治疗组为 34.7%(HR 0.936,95% CI 0.89-0.99)(Kaplan–Meier曲线见下图)。两组间肌肉、胆囊和肝脏系统不良反应及癌症的发生率无显著性差异。
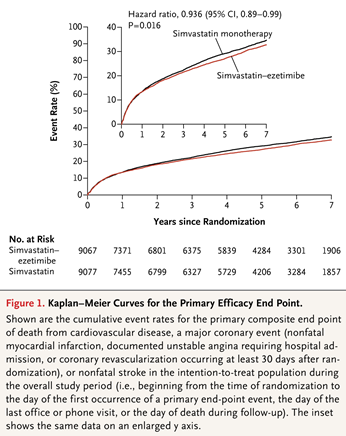
图源:Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes
依洛尤单抗是一种已在我国上市的PCSK9i。在FOURIER研究3中 ,27,564 名接受他汀类药物治疗且LDL-C≥70mg/dL的动脉粥样硬化性心血管疾病(ASCVD)患者被随机分为依洛尤单抗组(每两周 140 mg或每月420 mg)或安慰剂组。主要研究终点是由心血管死亡、心肌梗死、卒中、因不稳定心绞痛或冠脉血运重建住院的复合终点。次要研究终点是心血管死亡、心肌梗死或中风的复合终点。
经过48周的治疗,依洛尤单抗组LDL-C水平从92mg/dL降至30mg/dL(中位数),与安慰剂相比下降59%(P<0.001),同时,依洛尤单抗显着降低了主要研究终点(9.8% vs. 11.3%;HR 0.85;95% CI 0.79-0.92; P<0.001)和次要研究终点(5.9% vs.7.4%; HR 0.80;95% CI,0.73 - 0.88;P<0.001)发生率(见下图)。
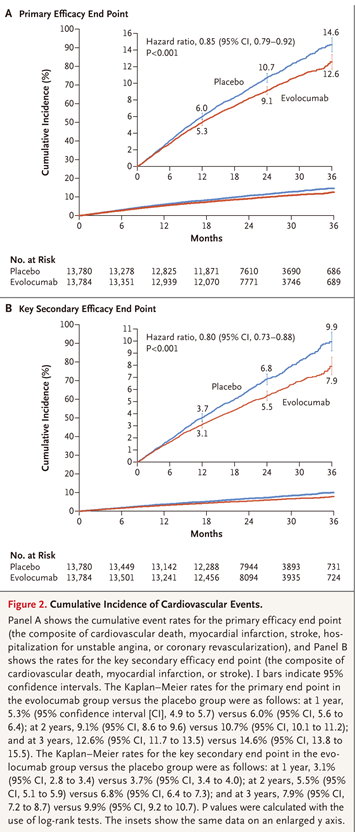
图源:FOURIER Steering Committee and Investigators. Evolocumab and clinical outcomes in patients with cardiovascular disease.
为了了解美国ASCVD患者LDL-C控制情况,Cannon CP等人开展了前瞻性的观察性研究GOULD4。该研究共纳入2016.12-2018.07期间符合纳排标准的ASCVD患者5006名,依据患者情况,将其分为三组:(1)PCSK9i组(接受了PCSK9i治疗);(2)LDL-C≥100mg/dL且未接受PCSK9i组;以及(3)LDL-C水平70-99mg/dL且未接受PCSK9i组。经过2年的治疗,仅有17.1%的患者接受了强化降脂治疗。在LDL-C≥100mg/dL及70-99mg/dL患者中,分别有22.4%和14.4%的患者接受了强化降脂治疗,6.4%和6.3% 的患者增加了他汀的使用剂量;6.8%和4.5%的患者加用了依折麦布;6.3%和2.2%的患者加用了PCSK9i。91.7%的PCSK9i的患者在两年后仍然接受PCSK9i治疗。在接受了血脂检测的患者中,LDL-C≥100mg/dL,70-99mg/dL以及PCSK9i组分别有21.0%、33.9%、52.4%的患者达到了LDL-C<70mg/dL的治疗目标。
虽然2018美国心脏病学会指南以及2020年欧洲心脏病学会/欧洲动脉粥样硬化学会最新指南均强调了ASCVD患者血脂达标的意义,但大部分血脂>70mg/dL的患者并未得到强化降脂治疗,三分之二的患者血脂仍然高于控制目标。相信这种情况在我国也同样存在,血脂达标仍将是未来我国公共卫生工作的重要内容。
参考文献:
1. Baigent C, Blackwell L, Emberson J, et al. Cholesterol Treatment Trialists’ (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: ameta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010;376(9753):1670-1681.
2. Cannon CP, BlazingMA, Giugliano RP, et al. IMPROVE-IT Investigators. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015;372(25):2387-2397.
3. Sabatine MS, Giugliano RP, Keech AC, et al. FOURIER Steering Committee and Investigators. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017;376(18): 1713-1722.
4. Cannon CP, Lemos JA, Rosenson RS, et al. Use of Lipid-Lowering Therapies Over 2 Years in GOULD, a Registry of Patients With Atherosclerotic Cardiovascular Disease in the US. JAMA Cardiol 2020. doi: 10.1001/jamacardio.2021.1810. Online ahead of print.
京东健康互联网医院医学中心
作者简介:李丹丹,首都医科大学附属北京友谊医院,研究方向为循证药学。为患者提供专业的用药指导,同时为临床医护人员提供最佳用药参考。
-


酱油,是人们在烹调时最常用到的调味品之一,无论炒菜、做汤、又或者是凉拌等,各种菜品都离不开酱油的协同调味作用,可以说酱油是厨师们或者家庭掌勺者们离不开的好帮手,有着重要的增色、添鲜作用。但是,在市面上混的“风生水起”的食品谣言也来了,有传言说吃酱油会让皮肤变黑;有传言说受伤的人吃了酱油连伤口都会长成黑的。听了这些传言之后,酱油如果有眼泪,也应该是泪流满面了吧。好吧,接下来我们就一起重新认识一下感觉自己比窦娥还冤的酱油吧。

酱油的真相
酱油,是我国人民生活中常见的一种传统调味品,颜色呈红褐色,且有特有的酱香,可以增进人们的食欲。酱油是由蛋白质、淀粉原料发酵而成,这些发酵原料一般包括大豆、豆粕、小麦、麸皮等,所以酱油中含有氨基酸、B族维生素、糖、有机酸、醇、酚以及棕红色素等多种物质,无论是炒菜,还是调拌饺子馅儿时放一点,既能起到调色的作用,又能增加香气和鲜味。市面上销售的酱油,除了上述的发酵原料外,还包括食盐,所以酱油中其实是含有一定量隐形盐的,在炒菜或者拌馅时,如果放了酱油可以少放一点食盐。

人的皮肤为什么会变黑
人的皮肤中存在一种黑色素细胞,其中含有的酪氨酸在酪氨酸酶的激活作用下,会产生一种叫“黑色素”的物质,这种黑色素产生的越多,人的皮肤的肤色就会越深,也就是人们常说的“皮肤变黑”。人们皮肤中黑色素量的多少,不但取决于酪氨酸的多少和酪氨酸酶的活性,还与人的遗传基因、太阳光的照射等情况关系密切。

之所以会有“吃酱油会让人的皮肤变黑”的传言,主要是因为酱油中含有丰富的氨基酸,当然也有一定量的酪氨酸。的确,酱油中含有部分酪氨酸,但是仅凭此点就断定“吃酱油会变黑”是不科学的,因为酪氨酸的含量再多,如果酪氨酸酶的活性不够,也不能产生黑色素,而酪氨酸酶的活性绝对不是吃酱油多少能够决定的。再者,含有酪氨酸的食物有很多,它是蛋白质的构成单位之一,所以几乎所有蛋白质食物都有这种氨基酸,最明显的例子就是:牛奶。牛奶在人们的日常饮食中也是非常常见的食物,但也没见有人说喝牛奶会让人变黑,不是吗?

伤口变黑与酱油也没有半毛钱关系
皮肤变黑与酱油没有关系,伤口的颜色变深与酱油其实也没有什么关系。伤口的愈合其实是细胞的增生活动,人体内的细胞是有寿命的,在细胞不断的死亡和分裂增殖的过程中,人体有条不紊的进行着新陈代谢。当身体因出现伤口而改变了那个身体部位原有的状态时,细胞就会不断增生,随之新的组织也会开始不断的分裂、愈合,从而对伤口除做着修复工作,直至其愈合。在伤口愈合的整个过程当中,会出现色素的沉淀,从而使伤口处的颜色表现的比较深沉,与吃不吃酱油真的一点关系都没有。
展开更多














