青少年儿童心理科
展开更多
-
您好 咨询乳腺增生点击查看
总交流次数
-
总回复次数
-
患者: -
扑尔敏可以和安乃近和**点击查看
总交流次数
-
总回复次数
-
患者: -
人工服务,,,点击查看
总交流次数
-
总回复次数
-
患者: -
你好,淡盐水鼻滴真的幼儿能用吗点击查看
总交流次数
-
总回复次数
-
患者: -
备孕中妇检点击查看
总交流次数
-
总回复次数
-
患者: -
性生活的时候龟头进不去,硬的慢,软的快,有四五年手淫史
总交流次数
-
总回复次数
-
患者: -
脸上出油鼻子黑头点击查看
总交流次数
-
总回复次数
-
患者: -
一周六的孩子被蚊子咬了眼皮子,这个药膏能抹眼皮上吗
总交流次数
-
总回复次数
-
患者: -
1岁半宝宝平时肚子胀可以吃吧点击查看
总交流次数
-
总回复次数
-
患者: -
最近几天一直想吐,但是吐不出来的那种,吃饭也想吐,吃几口就恶心的不行
总交流次数
-
总回复次数
-
患者:
展开更多
-
 点击查看å今天有一位患者咨询,他吃着3种降压药。今年体检发现肝功能(AST,ALT)指标偏高了。这位患者的第一反应,就是看降压药的副作用。其实,他吃的这几种降压药,引起转氨酶高的可能性很小。更大概率是平时吃的油腻,或者活动少、或者经常饮酒引起的脂肪肝所致。有一些可能会引起肝脏转氨酶升高的药物,比如他汀类降脂药,医生在处方时,会嘱咐定期复查肝功能。无论如何,转氨酶高了,应该找专科医生看一下,同时注意少喝酒,尽量不喝酒。
点击查看å今天有一位患者咨询,他吃着3种降压药。今年体检发现肝功能(AST,ALT)指标偏高了。这位患者的第一反应,就是看降压药的副作用。其实,他吃的这几种降压药,引起转氨酶高的可能性很小。更大概率是平时吃的油腻,或者活动少、或者经常饮酒引起的脂肪肝所致。有一些可能会引起肝脏转氨酶升高的药物,比如他汀类降脂药,医生在处方时,会嘱咐定期复查肝功能。无论如何,转氨酶高了,应该找专科医生看一下,同时注意少喝酒,尽量不喝酒。

-
 点击查看å
点击查看å甲状腺结节的超声分级:
0:无结节,超声表现为弥漫性病变,恶性风险0。1:结节阴性。超声表现为正常甲状腺(或术后),恶性风险0。2:结节良性。超声表现为囊性或实性为主,形态规则、边界清楚的良性结节,恶性风险0。3:结节可能良性。超声表现为不典型的良性结节,恶性风险<5%。4:结节可疑恶性。超声表现为恶性征象(实质性、低回声或极低回声、微小钙化、边界模糊/微分叶、纵横比>1),恶性风险5%~85%。4a:具有1种恶性征象,恶性风险5%~10%。4b:具有2种恶性征象,恶性风险10%~50%。4c:具有3-4种恶性征象,恶性风险50%85%。5:恶性,超声表现超过4种恶性征象,尤其是有微钙化和微分裂症,恶性风险85%~100%。6:恶性,为经病理证实的恶性病变。甲状腺结节通常以直径1cm为界,如果是直径大于1cm的甲状腺结节,进一步行甲状腺细针穿刺抽吸活检术,取甲状腺组织以明确甲状腺结节的性质到底是恶性还是良性。但是,以下情况不建议行细针穿刺抽吸活检术:①、直径大于1cm,ECT证实为热结节,超声证实结节为纯囊性结节,这些结节考虑良性的可能性比较大,细针穿刺抽吸活检术不作为常规的检查。②、直径小于1cm,也不建议常规行细针穿刺抽吸活检术,可以定期随访观察结节的性质、大小,如果甲状腺结节在短期内没有明显增大或者性质没有明显变化,可以继续观察。如果甲状腺结节在短期内有明显的增大,性质有明显变化,建议进一步行甲状腺细针穿刺抽吸活检术,明确甲状腺结节性质。 -
 点击查看å
点击查看å为配合新修订《医疗器械监督管理条例》的实施,加强对医疗器械召回工作的管理,国家食品药品监督管理总局对现行《医疗器械召回管理办法(试行)》(卫生部令第82号)进行了修订,形成了《医疗器械召回管理办法(征求意见稿)》,现向社会公开征求意见。请于2016年9月30日前将意见反馈国家食品药品监督管理总局医疗器械监管司。

医疗器械召回管理办法(征求意见稿)
第一章 总 则
第一条 为加强医疗器械监督管理,发现和控制医疗器械缺陷产品,消除医疗器械安全隐患,保证医疗器械的安全、有效,保障人体健康和生命安全,根据《医疗器械监督管理条例》《国务院关于加强食品等产品安全监督管理的特别规定》,制定本办法。
第二条 中华人民共和国境内医疗器械的召回及其监督管理,适用本办法。
第三条 本办法所称医疗器械召回,是指医疗器械生产企业(包括进口医疗器械的境外制造厂商在中国境内指定的代理人,下同)按照规定的程序对其已上市销售的某一类别、型号或者批次的缺陷产品,采取警示、检查、修理、重新标签、修改并完善说明书、软件升级、替换、收回、销毁等方式进行处理的行为。
第四条 召回产品的范围包括:
(一)正常使用情况下存在可能危及人体健康和生命安全的不合理的风险的产品;
(二)不符合强制性标准、经注册或者备案的产品技术要求的产品;
(三)不符合医疗器械生产、流通质量管理有关规定导致可能存在不合理风险的产品;
(四)其他需要召回的产品。
第五条 医疗器械生产企业是控制与消除产品缺陷的主体,应当主动对缺陷产品实施召回。
第六条 医疗器械生产企业应当按照本办法的规定建立和完善医疗器械召回管理制度,收集医疗器械安全相关信息,对可能的缺陷产品进行调查、评估,及时召回缺陷产品。
进口医疗器械的境外制造厂商在中国境内指定的代理人应当将仅在境外实施医疗器械召回的有关信息及时报告国家食品药品监督管理总局;凡涉及在境内实施召回的,中国境内指定的代理人应按照本办法的规定组织实施。
医疗器械经营企业、使用单位应当积极协助医疗器械生产企业对缺陷产品进行调查、评估,主动配合生产企业履行召回义务,按照召回计划及时传达、反馈医疗器械召回信息,控制和收回缺陷产品。
第七条 医疗器械经营企业、使用单位发现其经营、使用的医疗器械可能为缺陷产品的,应当立即暂停销售或者使用该医疗器械,及时通知医疗器械生产企业或者供货商,并向所在地省、自治区、直辖市食品药品监督管理部门报告;使用单位为医疗机构的,还应当同时向所在地省、自治区、直辖市卫生行政部门报告。
医疗器械经营企业、使用单位所在地省、自治区、直辖市食品药品监督管理部门收到报告后,应当及时通报医疗器械生产企业所在地省、自治区、直辖市食品药品监督管理部门。
第八条 召回医疗器械的生产企业所在地省、自治区、直辖市食品药品监督管理部门负责医疗器械召回的监督管理工作,其他省、自治区、直辖市食品药品监督管理部门应当配合、协助做好本行政区域内医疗器械召回的有关工作。
国家食品药品监督管理总局监督全国医疗器械召回的管理工作。
第九条 国家食品药品监督管理总局和省、自治区、直辖市食品药品监督管理部门应当建立医疗器械召回信息通报和公开制度,采取有效途径向社会公布缺陷产品信息和召回信息,必要时向同级卫生计生部门通报相关信息。
第二章 医疗器械缺陷的调查与评估
第十条 医疗器械生产企业应当按照规定建立健全医疗器械质量管理体系和医疗器械不良事件监测系统,收集、记录医疗器械的质量投诉信息和医疗器械不良事件信息,对收集的信息进行分析,对可能存在的缺陷进行调查和评估。
医疗器械经营企业、使用单位应当配合医疗器械生产企业对有关医疗器械缺陷进行调查,并提供有关资料。
第十一条 医疗器械生产企业应当按照规定及时将收集的医疗器械不良事件信息向食品药品监督管理部门报告,食品药品监督管理部门可以对医疗器械不良事件或者可能存在的缺陷进行分析和调查,医疗器械生产企业、经营企业、使用单位应当予以配合。
第十二条 对医疗器械缺陷进行评估的主要内容包括:
(一)在使用医疗器械过程中是否发生过故障或者伤害;
(二)在现有使用环境下是否会造成伤害,是否有科学文献、研究、相关试验或者验证能够解释伤害发生的原因;
(三)伤害所涉及的地区范围和人群特点;
(四)对人体健康造成的伤害程度;
(五)伤害发生的概率;
(六)发生伤害的短期和长期后果;
(七)其他可能对人体造成伤害的因素。
第十三条 根据医疗器械缺陷的严重程度,医疗器械召回分为:
(一)一级召回:使用该医疗器械可能或者已经引起严重健康危害的;
(二)二级召回:使用该医疗器械可能或者已经引起暂时的或者可逆的健康危害的;
(三)三级召回:使用该医疗器械引起危害的可能性较小但仍需要召回的。
医疗器械生产企业应根据具体情况确定召回级别并根据召回级别与医疗器械的销售和使用情况,科学设计召回计划并组织实施。
第三章 主动召回
第十四条 医疗器械生产企业按照本办法第十条、第十二条的要求进行调查评估后,确定为医疗器械缺陷产品的,应当立即决定召回。
第十五条 医疗器械生产企业做出医疗器械召回决定的,一级召回应在1日内,二级召回应在3日内,三级召回应在7日内,通知到有关医疗器械经营企业、使用单位或者告知使用者。
召回通知至少应当包括以下内容:
(一)召回医疗器械名称、批次等基本信息;
(二)召回的原因;
(三)召回的要求:如立即暂停销售和使用该产品、将召回通知转发到相关经营企业或者使用单位等;
(四)召回医疗器械的处理方式。
第十六条 医疗器械生产企业作出医疗器械召回决定的,应当立即书面告知所在地省、自治区、直辖市食品药品监督管理部门,并且在5日内将《医疗器械召回事件报告表》(见附表1)、调查评估报告和召回计划提交至所在地省、自治区、直辖市食品药品监督管理部门备案。
省、自治区、直辖市食品药品监督管理部门应当及时将一级召回的有关情况报告国家食品药品监督管理总局。
第十七条 调查评估报告应当包括以下内容:
(一)召回医疗器械的具体情况,包括名称、批次等基本信息;
(二)实施召回的原因;
(三)调查评估结果;
(四)召回分级。
召回计划应当包括以下内容:
(一)医疗器械生产销售情况及拟召回的数量;
(二)召回措施的具体内容,包括实施的组织、范围和时限等;
(三)召回信息的公布途径与范围;
(四)召回的预期效果;
(五)医疗器械召回后的处理措施。
第十八条 食品药品监督管理部门可以对医疗器械生产企业提交的召回计划进行评估,认为医疗器械生产企业所采取的措施不能有效消除缺陷或控制产品风险的,应当要求医疗器械生产企业采取提高召回等级、扩大召回范围、缩短召回时间或者改变召回产品的处理方式等更为有效的措施进行处理。
第十九条 医疗器械生产企业对上报的召回计划进行变更的,应当及时报所在地省、自治区、直辖市食品药品监督管理部门备案。
第二十条 医疗器械生产企业在实施召回的过程中,应当根据召回计划定期向所在地省、自治区、直辖市食品药品监督管理部门提交《召回计划实施情况报告》(见附表2),报告召回计划实施情况。
第二十一条 医疗器械生产企业对召回医疗器械的处理应当有详细的记录,并向医疗器械生产企业所在地省、自治区、直辖市食品药品监督管理部门报告。对通过警示、检查、修理、重新标签、修改并完善说明书、软件升级、替换、销毁等方式能够消除产品缺陷的,可以在产品所在地完成上述行为。需要销毁的,应当在食品药品监督管理部门监督下销毁。
第二十二条 医疗器械生产企业应在召回完成后10日内对召回效果进行评价,并向所在地省、自治区、直辖市食品药品监督管理部门提交医疗器械召回总结评估报告。
第二十三条 食品药品监督管理部门应当自收到总结报告之日起10日内对报告进行审查,并对召回效果进行评估,认为召回尚未有效消除风险或缺陷的,应当要求医疗器械生产企业重新召回。
第四章 责令召回
第二十四条 食品药品监督管理部门经过调查评估,认为医疗器械生产企业应当召回医疗器械缺陷产品而未主动召回的,应当责令医疗器械生产企业召回医疗器械。
必要时,食品药品监督管理部门应当要求医疗器械生产企业、经营企业和使用单位立即暂停生产、销售和使用,并告知消费者立即暂停使用该缺陷产品。
第二十五条 食品药品监督管理部门作出责令召回决定,应当将责令召回通知书送达医疗器械生产企业,通知书包括以下内容:
(一)召回医疗器械的具体情况,包括名称、批次等基本信息;
(二)实施召回的原因;
(三)调查评估结果;
(四)召回要求,包括范围和时限等。
第二十六条 医疗器械生产企业收到责令召回通知书后,应当按照本办法第十五条、第十六条的规定通知医疗器械经营企业和使用单位或者告知使用者,制定、提交召回计划,并组织实施。
第二十七条 医疗器械生产企业应当按照本办法第十九条、第二十条、第二十一条、第二十二条的规定向食品药品监督管理部门报告医疗器械召回的相关情况,进行召回医疗器械的后续处理。
食品药品监督管理部门应当按照本办法第二十三条的规定对医疗器械生产企业提交的医疗器械召回总结报告进行审查,并对召回效果进行评价,必要时通报同级卫生行政部门。经过审查和评价,认为召回不彻底,尚未有效消除缺陷的,食品药品监督管理部门应当要求医疗器械生产企业重新召回。
第五章 法律责任
第二十八条 食品药品监督管理部门确认医疗器械生产企业因违反法律、法规、规章规定造成上市医疗器械存在缺陷,依法应当给予行政处罚,但该企业已经采取召回措施主动消除或者减轻危害后果的,依照《中华人民共和国行政处罚法》的规定从轻或者减轻处罚;违法行为轻微并及时纠正,没有造成危害后果的,不予处罚。
医疗器械生产企业召回医疗器械的,不免除其依法应当承担的其他法律责任。
第二十九条 医疗器械生产企业违反本办法规定,发现医疗器械缺陷产品而没有主动召回医疗器械的,责令召回医疗器械,并处应召回医疗器械货值金额3倍的罚款;造成严重后果的,由原发证部门吊销医疗器械产品注册证书,直至吊销《医疗器械生产企业许可证》。
第三十条 医疗器械生产企业违反本办法第二十四条规定,拒绝召回医疗器械的,依据《医疗器械监督管理条例》第六十六条的规定进行处理。
第三十一条 医疗器械生产企业有下列情形之一的,予以警告,责令限期改正,并处3万元以下罚款:
(一)违反本办法第十五条规定,未在规定时间内将召回医疗器械的决定通知到医疗器械经营企业、使用单位或者告知使用者的;
(二)违反本办法第十八条、第二十三条、第二十七条第二款规定,未按照食品药品监督管理部门要求采取改正措施或者重新召回医疗器械的;
(三)违反本办法第二十一条规定,未对召回医疗器械的处理作详细记录或者未向食品药品监督管理部门报告的。
第三十二条 医疗器械生产企业有下列情形之一的,予以警告,责令限期改正;逾期未改正的,处3万元以下罚款:
(一)未按本办法规定建立医疗器械召回制度的;
(二)拒绝配合食品药品监督管理部门开展调查的;
(三)未按照本办法规定提交《医疗器械召回事件报告表》、调查评估报告和召回计划、医疗器械召回计划实施情况和总结报告的;
(四)变更召回计划,未报食品药品监督管理部门备案的。
第三十三条 医疗器械经营企业、使用单位违反本办法第七条第一款规定的,责令停止销售、使用存在缺陷的医疗器械,并处5000元以上3万元以下罚款;造成严重后果的,由原发证部门吊销《医疗器械经营企业许可证》。
第三十四条 医疗器械经营企业、使用单位拒绝配合有关医疗器械缺陷调查、拒绝协助医疗器械生产企业召回医疗器械的,予以警告,责令限期改正;逾期拒不改正的,处3万元以下罚款。
第三十五条 食品药品监督管理部门及其工作人员不履行职责或者滥用职权的,按照有关法律、法规规定予以处理。
第六章 附 则
第三十六条 召回的医疗器械已经植入人体的,医疗器械生产企业应当与医疗机构和患者共同协商,根据召回的不同原因,提出对患者的处理意见和应采取的预案措施。
第三十七条 召回的医疗器械给患者造成损害的,患者可以向生产企业要求赔偿,也可以向医疗器械经营企业、使用单位要求赔偿。患者向医疗器械经营企业、使用单位要求赔偿的,医疗器械经营企业、使用单位赔偿后,有权向负有责任的生产企业追偿。
第三十八条 本办法自 年 月 日起施行。
-
 点击查看å
点击查看å什么样的男人一看就虚?
-
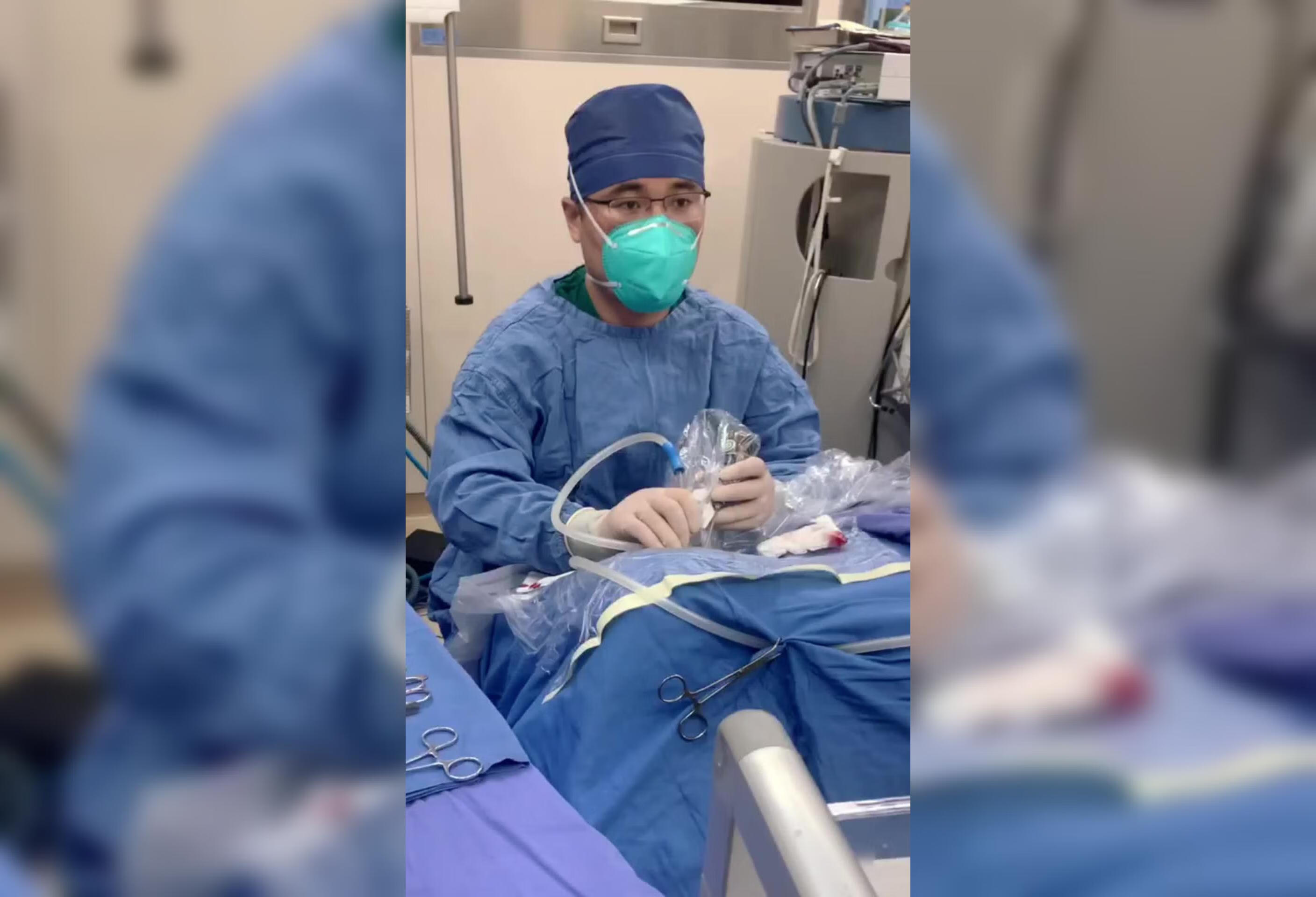
重要的事情说三遍!耳病患者不能吸烟!这位患者屡教不改,现在需要二次手术了!您一定要记住,吸烟会损伤耳部的微循环,一手烟、二手烟都不行!如果您家里有中耳炎、胆脂瘤的患者,请让他远离香烟!#医学科普 #耳鼻喉薛玉斌
-
 点击查看å
点击查看å脸部红血丝原因很多,主要有以下几点: 1、少部分人是先天性红血丝,毛细血管扩张; 2、大部分是后天性,比方环境因素引起。如果住在西藏、内蒙等地方,紫外线强度比较大,而且比较干燥,皮肤屏障受损,皮肤角质层变薄,毛细血管会反射性扩张,导致红血丝; 3、面部皮炎,屏障受损,有一些人用劣质化妆品,化妆品里面含有激素等会导致红血丝; 4、过度清洁造成的屏障受损也会导致红血丝。 总之,红血丝原因跟屏障受损有关,一定要加强屏障修复,多用保湿霜、修复霜,减少皮肤刺激,减少酒精类化妆品刺激,慢慢会改善红血丝,红血丝如果非常厉害,可以做美容激光祛除红血丝。
-
 点击查看å
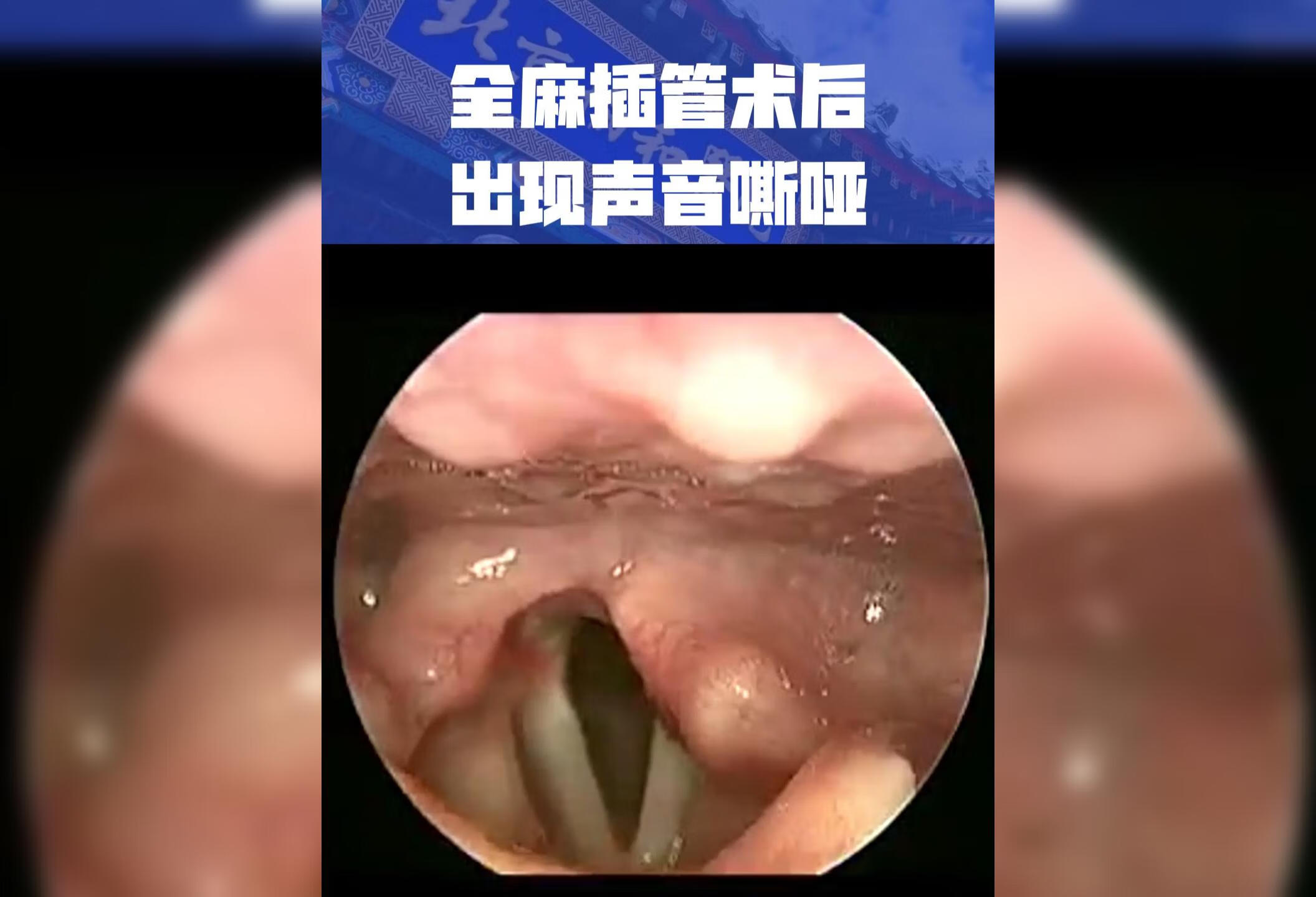
点击查看å#声带麻痹 #医学科普 #北京协和医院李五一
-
 点击查看å
点击查看å人工耳蜗手术中什么原因会导致植入体移位 #成人 #儿童 #听力 #人工耳蜗 #人工耳蜗植入手术
-
 点击查看å
点击查看å甲状腺术后怕冷是什么原因?
-
 点击查看å
点击查看å甲状腺癌少喝三种水可以改善甲状腺。
-

我家孩子已经去让医生看了两次了,用了两个月贴的药,现在抽动症状基本没有了,只有紧张的时候眼睛还会眨的厉害,面部表情偶尔还有。但是现在疫情严重,我们不敢随便出门,所以只能通过线上问诊咨询医生下一步该怎么办。
我们非常感谢医生在这段时间里的治疗和指导,孩子的病情得到了很大的改善。我们希望能通过线上问诊继续得到医生的帮助和指导,帮助孩子更好地度过这段特殊时期。
-
 点击查看
点击查看我最近总觉得自己像得了抑郁症,每天都非常不开心,提不起劲。吃饭时也没胃口,但是因为孩子得吃饭,所以不得不硬着头皮吃下去(抑郁和娃无关)。每天晚上都怎么也睡不着,要翻来覆去到两三点钟才能入睡。一旦孩子醒来,我就得起来照顾。特别是晚上更容易陷入沮丧,心情烦躁。不过在家人和外人面前,我会假装没事,表现得很正常。
-
 点击查看
点击查看我在京东互联网医院咨询了一位医生,对于孩子的病情和治疗方案给予了详细的解答,让我感到非常放心。医生非常耐心地和我沟通,给了我很多专业建议。我对孩子的情况和治疗方案有了更清晰的认识,感到非常满意。
在这次的咨询中,医生给了我很多关于孩子的睡眠问题和理解能力培养的建议,让我受益匪浅。医生的专业知识和细心态度让我对孩子的治疗充满了信心。
-

在互联网医院进行线上问诊是一种方便快捷的就医方式,患者可以在家中就能得到医生的专业建议和治疗方案。这种方式不仅省去了排队等候的时间,还能有效保护患者的隐私和个人信息。
在一次线上问诊中,患者向医生咨询了孩子的注意力缺陷问题,表示孩子吃了静灵一年效果不佳。医生通过详细询问患者孩子的情况,耐心倾听患者的描述,客观评估孩子的病情,并给出了专业的建议。
医生建议患者需要更换药物治疗,同时提醒患者要密切配合治疗,包括注意孩子的生活习惯和教育方式。患者对医生的建议表示感谢,同时提出了更多问题,医生也一一耐心回答,为患者提供了全面的解决方案。
结束线上问诊后,医生提醒患者可以在问诊记录中发起复诊,同时告知患者如需进一步诊疗可前往医院就诊。患者对医生的服务感到满意,表示会继续关注孩子的治疗情况。
-

我是一位拥有丰富医疗行业知识的专业人员,在这个医疗行业知识丰富的专业人员。
我擅长与患者进行沟通,倾听他们的主诉并提供支持和建议,具备良好的沟通能力,能够以友善的方式与患者交流。
我能够客观评价患者的病情,为他们提供最合适的治疗方案,具备耐心和细心的品质,关注患者的细节并给予关心。
-

我是一名担心孩子健康的家长,最近发现孩子十三岁的儿子沉迷于电视和小说,整天泡在家里,不愿外出活动,甚至连吃饭都要一边看电视一边进食。他不听父母和哥哥的劝告,坚持看电视到深夜,对学校的要求也不配合。这让我非常担心,于是决定通过互联网医院进行线上问诊。
在和医生的交流中,我得知孩子可能存在情绪冲动、自控能力不足的问题。医生建议我们带孩子去精神科、心理科或儿童医院的儿保科就诊,可以考虑药物治疗。医生的耐心和专业让我感到安心,我决定按照医生的建议尽快带孩子去医院就诊。
通过这次线上问诊,我意识到孩子的问题可能比我想象的严重,同时也感受到医生的专业和责任心。我会积极配合医生的治疗方案,希望孩子能早日康复,重新拥有健康快乐的生活。
-
 点击查看
点击查看今天上午,我带着我的女儿去京东互联网医院看诊,得知她被诊断为中度抑郁症。我向医生咨询了这种病是否能够通过治疗彻底治愈,希望能够给我的女儿一个更好的未来。
医生非常耐心地解释了治疗的情况,告诉我大部分孩子的治疗效果都是不错的,但需要坚持定期复诊,关注治疗后的情况是否有变化。医生还建议我在日常和孩子沟通时要注意自己的情绪,因为家长的改变对孩子的病情恢复非常重要。
在结束诊疗时,医生再次强调医生的回复仅为建议,如果需要诊疗,要前往医院就诊。
-

最近心情郁闷,呼吸困难,头晕,吐。我感到每天都像是在水里窒息一样,无法呼吸。学校的压力让我感到非常疲惫,我甚至想要逃离学校,逃离所有人的地方。每天都感到崩溃,宿舍也没有给我安全感,我真的需要散散心。
我尝试过和学校的心理老师谈,但他似乎无法真正帮助我。现在我选择在安徽合肥市找心理医生看门诊,希望能够得到更好的帮助。我知道自己需要安非他酮,希望医生可以配合开具处方。在这个过程中,我遇到了一些线上问诊的问题,但我坚持要求医生开具线下的诊单,这让我感到很困扰。
我希望医生可以尽快审核通过我的处方,让我可以一键预约药品。我已经购药,但处方已经过期。我希望医生可以给我一些建议,帮助我解决这个问题。
虽然这次线上问诊并不完美,但我仍然感谢医生的建议和帮助。我希望我的病情可以得到良好的控制,能够重新找到自己的平衡。
-

自从八月十几号开始,孩子开始服用丙戊酸镁和氟伏沙明,症状有了一定的缓解,能够进行学习。然而,最近又出现了头痛、头昏和焦躁的情况,晚上入睡困难,全身不适,需要不停地翻动和伸展才能稍微缓解。这些症状严重影响了孩子的生活质量。
对于这种情况,家长感到非常焦虑和无助,尝试了多种治疗方案,但效果都不尽如人意。在医生的建议下,家长积极配合治疗,但孩子的症状并未得到有效的缓解。
此外,孩子从小就体弱多病,注意力不集中,情绪问题逐渐加重,情绪稳定后才能进行进一步的评估。这些问题给孩子和家长都带来了巨大的困扰。
-

最近,我感到情绪低落,于是决定向医生咨询一下。我在网上预约了一家互联网医院的心理科医生,希望能够得到专业的建议。
开始咨询时,医生提醒我需要完整查看病例后开始诊疗,还告诉我6岁以下儿童开具处方时需要确认有监护人和专业医师陪伴。医生很贴心地提醒我不得开具特殊管理药品的处方。
在沟通中,医生很关心地询问了我的问题,非常耐心地和我交流。他告诉我下周四8:30来加号,并且在结束对话前嘱咐我做心理测试和心电图检查。医生的回复都非常及时,给了我很多关心和建议。
在问诊过程中,医生不断关心我的情况,询问了我的近期遭遇和服药情况。最后,医生给了我一些建议,并提醒我可以在问诊记录中发起复诊,或者前往医院就诊。
这次的问诊体验让我感到很温暖和安心,医生的细心和专业给了我很多帮助。
展开更多



