24年7月31日,号称“世界首款脑部再生治疗药”的人体体细胞干细胞加工产品获批日本,他便是我们今天的主角——vandefitemcel(SB623)。这款药物是一款可进行颅内植入的混悬液,用于治疗因创伤性脑损伤导致的慢性运动性瘫痪。值得注意的一点是,这款药物在日本的获批为有条件有时限的获批。

新药批准是基于在日本和美国进行的全球Ⅱ期临床试验,目前公开发表在期刊上的有两篇,分别是16年和21年发布。我们来看看这两项研究的主要效果。
干细胞输注的研究
两篇研究都使用了骨髓来源的间质干细胞(MSC),MSCs 有下列特性[1]:
1.免疫原性低;
2.可从不同的成人组织中分离出来,并在培养皿中以极大的扩增能力进行培养。
至于MSCs与神经系统的渊源,还得从神经系统疾病机制说起,间质干细胞与神经系统旁分泌信号有关,涉及免疫调节、神经保护、诱导内源性神经发生、血管生成和细胞外基质重塑等[1]。正是因为这些背后的机制,干细胞和神经修复似乎“天然契合”,故而干细胞正在被为神经领域疯狂探索中。
研究1主要对18 名病情稳定的慢性中风患者进行了 12个月的随访,就有效性而言,多项评分有所改善:
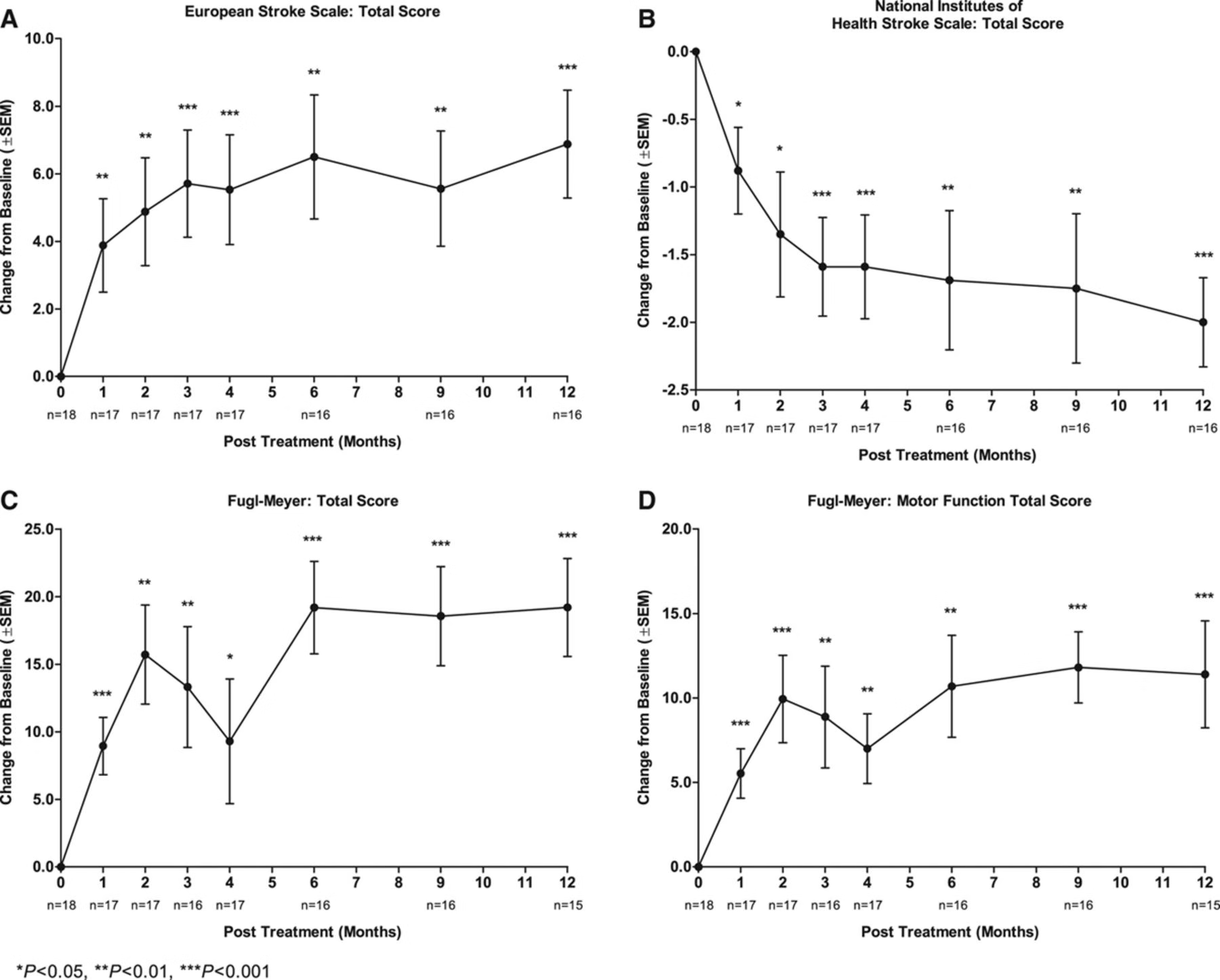
欧洲卒中量表:平均增加 6.88(95%置信区间,3.5 - 10.3;P < 0.001)
国立卫生研究院卒中量表:平均减少 2.00(95%置信区间,-2.7 至 -1.3;P < 0.001)
Fugl - Meyer 总分:平均增加 19.20(95%置信区间,11.4 - 27.0;P < 0.001)
Fugl - Meyer 运动功能总分:平均增加 11.40(95%置信区间,4.6 - 18.2;P < 0.001)。但改良 Rankin 量表未观察到变化。
在安全性方面,所有患者都经历了至少 1 次治疗期间出现的不良事件,6 名患者经历了 6 次严重的治疗期间出现的不良事件,其中 2 次可能或肯定与手术过程有关,但没与细胞治疗有关。所有严重的治疗期间出现的不良事件都已解决,且没有后遗症。没有剂量限制性毒性反应或死亡[3]。
研究2主要确定了后续研究干细胞所采用的量表差异,为期 1 年,是一项双盲随机手术假对照的Ⅱ期试验,也称 STEMTRA 试验。创伤性脑损伤(TBI)继发慢性运动功能缺损的患者(N = 61)接受了脑内立体定向植入修饰的骨髓来源间充质基质(SB623)细胞。通过多项量表对比测量[4]。
测量结果如下:
残疾评定量表为 - 1.5 分
Fugl - Meyer 上肢子量表为 6.2 分
Fugl - Meyer 下肢子量表为 3.2 分
Fugl - Meyer 运动量表为 8.4 分
总的来说,研究2后其后续继续临床试验奠定了技术基础,确定了后续试验的评分量表和评估方式。
此外,根据SanBio官网最新信息,目前正在进行上市后研究[5]。

具体如何输注?输多少怎么定?
这个药物是由健康成人骨髓液来源的间质细胞加工,当移植到脑内受损的神经组织时,会释放 FGF-2(一种蛋白质),促进受损神经细胞原本具有的再生能力,有望促进神经细胞的增殖和分化[6]。
适应证:与创伤性脑损伤相关的慢性运动性瘫痪的改善[7]。
用法用量 [7]:对于成人,使用专用的输送装置套件,通过脑立体定向手术,将5×10^6个人(同种异体)骨髓来源的间充质干细胞(300μL细胞悬液)植入到病灶周围的脑组织中。
通过在颅骨上制作的钻孔,沿着三条轨迹将细胞植入到病灶周围区域。对于每条轨迹,注射100μL细胞悬液,在总共5个位点上分别沉积20μL溶液,这些位点从最深位点开始间隔5 - 6mm。植入的速度应约为10μL/min。按照以下步骤进行植入:
1. 在开始操作之前,将专用输送装置套件中的导向&停止器和配备管芯的插入器连接到用于侵入性神经外科手术的头部固定装置上。
2. 解冻用于颅内植入的细胞悬液,用专用制备溶液洗涤,并使用专用制备溶液将细胞悬液的浓度调整为1.67×106个细胞/100μL。在将制备好的细胞悬液填充到专用输送装置套件中的固定有插管的微注射器之前,用专用制备溶液清洗该微注射器。
关于疾病[7]
创伤性脑损伤(TBI)是由头部受到强烈的外力作用引起的,例如交通事故或跌倒,这会损伤颅骨内的脑组织。TBI 的症状表现和出现时间在患者之间差异很大,并且根据大脑受影响的区域,患者可能会经历运动功能障碍或高级大脑功能障碍等后遗症。
研究表明,被破坏或受损的脑组织不会自然再生,进入 TBI 慢性期并出现运动性瘫痪的患者,其日常生活和社交生活将受到终身影响,这表明存在着重大的未满足的医疗需求。
关于SanBio
SanBio 致力于再生细胞药的研究、开发、制造和销售的再生细胞业务。主要针对现有医疗・药品无法应对、未满足医疗需求较高的中枢神经系统领域的疾病[6]。
参考文献:
1.Azevedo-Pereira RL, Aizman I, Nejadnik B. Mesenchymal Stem Cells Promote an Increase in Neuronal Oscillation via Glutamate Tonic Release. Neuroscience. 2024 Aug 6;552:76-88. doi: 10.1016/j.neuroscience.2024.06.015. Epub 2024 Jun 21. PMID: 38909673.
2.Study of Modified Stem Cells (SB623) in Patients With Chronic Motor Deficit From Ischemic Stroke (ACTIsSIMA)
3.Steinberg GK, Kondziolka D, Wechsler LR, Lunsford LD, Coburn ML, Billigen JB, Kim AS, Johnson JN, Bates D, King B, Case C, McGrogan M, Yankee EW, Schwartz NE. Clinical Outcomes of Transplanted Modified Bone Marrow-Derived Mesenchymal Stem Cells in Stroke: A Phase 1/2a Study. Stroke. 2016 Jul;47(7):1817-24. doi: 10.1161/STROKEAHA.116.012995. Epub 2016 Jun 2. PMID: 27256670; PMCID: PMC5828512.
4.Kawabori M, Weintraub AH, Imai H, Zinkevych I, McAllister P, Steinberg GK, Frishberg BM, Yasuhara T, Chen JW, Cramer SC, Achrol AS, Schwartz NE, Suenaga J, Lu DC, Semeniv I, Nakamura H, Kondziolka D, Chida D, Kaneko T, Karasawa Y, Paadre S, Nejadnik B, Bates D, Stonehouse AH, Richardson RM, Okonkwo DO. Cell Therapy for Chronic TBI: Interim Analysis of the Randomized Controlled STEMTRA Trial. Neurology. 2021 Feb 22;96(8):e1202-e1214. doi: 10.1212/WNL.0000000000011450. PMID: 33397772; PMCID: PMC8055341.
5.https://www.sanbio.com/
6.基礎研究結果のお知らせ:主要開発品SB623が神経活動とネットワーク形成を促進することを示した論文がNeuroscienceに掲載
7.SanBio Obtains Marketing Approval for “AKUUGO®Suspension for Intracranial Implantation” (INN: Vandefitemcel) as a Therapeutic Agent for Improving Chronic Motor Paralysis From Traumatic Brain Injury (TBI)
 京东健康互联网医院
京东健康互联网医院
 网站导航
网站导航
 30
30

 29
29
 42
42

 29
29
 0
0
 0
0
 0
0

 0
0
 0
0
 0
0