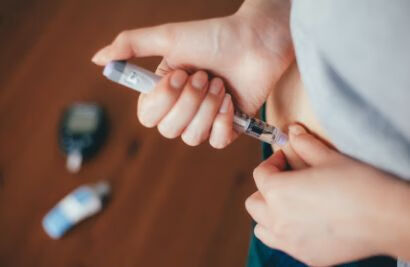
胰岛素的注射时间主要分为以下几种:餐前注射、餐时注射、餐中、餐后注射、即时注射和睡前注射。
餐前注射——常规短效胰岛素及预混人胰岛素
餐前注射主要适用于常规短效胰岛素及预混人胰岛素。
常规短效胰岛素是一种六聚体胰岛素,皮下注射后,由于这种胰岛素因“体积大”不能被吸收,需要“解聚”成体积小一点的单聚体才能被吸收入血发挥作用,从而使得其注射后到起效需要一定的时间间隔。
所以,为了使这种胰岛素与餐后血糖高峰同步,常规短效胰岛素就需要在餐前注射。餐前多久注射呢?经典而片面的解释——餐前半小时。
经典,是指多年来就是这样建议的;片面,是指“餐前半小时”并不精准。
应该如何做?
餐前应检测血糖,按照餐前血糖数值决定注射时间。
A、住院进行胰岛素强化的患者(要求严格):餐前血糖在3.9~6.7mmol/L的,常规胰岛素在餐前15分钟左右注射,以防止胰岛素相对饮食提早发挥作用而出现低血糖;餐前血糖在6.7~10.0mmol/L者,餐前30分钟注射;餐前血糖高于10.0mmol/L者,在餐前45分钟注射。
B、老年患者或在家自行注射胰岛素的患者:餐前血糖5~7mmol/L,可以在餐前10~15分钟注射;餐前血糖在7~12mmol/L者,餐前30分钟注射;餐前血糖在12mmol/L以上者,餐前45分钟注射。
C、单用中效胰岛素者,一般餐前30~60分钟注射,也可遵从医嘱,灵活制定注射时间。
D、使用预混人胰岛素(如诺和灵30R、50R以及优泌林30/70、甘舒霖30/70等),每天2次餐前注射的,注射与就餐的时间间隔可参考A或B。
餐时注射——速效、超短效胰岛素类似物及其预混制剂
餐时注射主要适用于速效或超短效胰岛素类似物及其预混制剂。
速效或超短效胰岛素类似物为单聚体结构,注射后不需要“解聚”而直接被吸收,因而吸收快,起效时间短,进餐时不需要提前注射,而注射后即可立即进食。速效胰岛素类似物的作用高峰时间一般为注射后1~3小时,餐时注射,正好可以降低餐后高血糖。同时,其作用维持时间较短,到下一餐前时胰岛素作用很少,下一餐前低血糖风险因此减少。
速效胰岛素类似物相对于常规短效胰岛素而言,注射后即可进餐,餐后血糖更好,下餐前低血糖风险更低,被称为“第三代胰岛素”。
速效或超短效胰岛素类似物一般是餐前即刻(餐时)注射。但是,
➤如果餐前血糖小于4~6mmol/L,也可以餐中甚至餐后注射;
➤如果餐前血糖超过目标值2~3mmol/L,就建议提前时间注射了。比如,目标餐前血糖值是<7mmol/L,而实际血糖为10mmol/L,则可在餐前10~15分钟左右注射,目的是让提前注射的胰岛素发挥作用,在食物升高血糖之前,把血糖控制下来,以预防餐后更高血糖数值的出现。
当发现餐前血糖高的时候,很多人常常采取的方法是增加马上要注射的胰岛素剂量,胰岛素泵的调整原则里面也是这样建议的。但本人更建议用延长注射时间的方法来控制。这次的餐前高血糖是因为之前的“过错”(胰岛素量少了,或者上餐吃多了等),增加马上要注射的胰岛素,看似很有道理,但这仅仅是“追加”,是一种“补救”,这对总结抗糖经验,提高抗糖技巧没有多大帮助。过后,我们更应该总结的是:为什么这次餐前血糖高了?
当发现餐前高血糖了,延长注射与进餐间隔时间的方法,是我的一种推荐,但也是有前提条件,即:餐前血糖超过目标值2~3mmol/L,也就是说这个餐前的高血糖并不是“非常高”,可以采取上述“延长时间”的方法,而当这个餐前的高血糖已经高得“飞起来了”,增加胰岛素剂量的做法才会被更推荐。此为:急则治其标。
我经常说的一句话:要允许血糖的波动,在波动中才能找到规律。“缓则治其本”,就是说血糖出现缓慢可控的波动时,寻找波动的根源更重要。
上面所说“餐时注射”的胰岛素,主要是速效或超短效胰岛素类似物;关于灵活餐前注射时间的提法,也适用于预混胰岛素类似物(如诺和锐30、诺和锐50、优泌乐25、优泌乐50等);而关于餐前高血糖要增加胰岛素剂量提法的,则只适用于超短效胰岛素类似物(诺和锐、优泌乐等)以及常规短效胰岛素,而不能适用于各型预混胰岛素及类似物。
餐中、餐后注射
➤上面提到当餐前血糖小于4~6mmol/L,可以餐中甚至餐后注射速效胰岛素类似物。
➤这里更想提醒大家的是,当患者出现精神意识障碍或胃肠道疾病(呕吐)及严重影响食欲的时候,进食的时间和数量都难以估算,此时也建议采用餐后注射。此时餐后注射的胰岛素剂量,则要根据具体的进餐情况而制定。
➤对于糖尿病胃轻瘫严重的患者,餐后注射也是常常被推荐的。
即时注射——胰岛素泵或需进行严格血糖控制
“即时注射”一般见于使用胰岛素泵,或需要更严格血糖控制的时候。当血糖超过目标范围,即可采取“即时注射”。此时的胰岛素,仅适用于短效胰岛素或速效胰岛素类似物,各种预混型胰岛素及中长效胰岛素及类似物都是不适合的。
“即时注射”胰岛素时,还要高度关注体内的胰岛素剩余作用,以防低血糖的发生。使用胰岛素泵,当餐后2h血糖或睡前血糖很高时,通过“1800法则”计算出需要补充的胰岛素剂量,常常不能“全额补充”,而只能用其50%~80%,道理就在这里。
鉴于上面提到的“急则治其标,缓则治其本”之精神,除非高血糖很严重,我一般不建议患者“私自追加即时胰岛素”,应该及时与主管医生联系。
睡前注射——中、长效胰岛素类似物
睡前注射的胰岛素一般是中效或长效胰岛素类似物(如:甘精胰岛素、地特胰岛素、低精蛋白锌胰岛素)。
睡前中效或长效胰岛素类似物模拟基础胰岛素水平,有效抑制肝糖输出,减少脂肪分解,保持基础血糖(尤其是空腹血糖)的平稳。中、长效胰岛素的用量调整一般依据空腹血糖数值。有患者睡前血糖偏高就增加此时注射的中长效,是大错!
作为睡前注射的胰岛素,在时间上的安排也有不同。中效胰岛素(NPH),一般是建议晚餐后4小时左右(防止与晚餐前胰岛素作用重叠太多),即晚上22点左右。NPH作用高峰在注射后6~8小时,此时间正好落在次日凌晨,从而更好应对“黎明现象”。而长效胰岛素类似物,由于作用时间更长,所以注射时间相对宽松,可以在晚上19~22点相对固定的一个时间注射即可。
很多注射长效胰岛素类似物的患者仍然采用晚上22点注射,有时候是“刻意等待”,这就大可不必。医院固定这个时间,只是护士监测睡前血糖和注射睡前胰岛素的一个“惯用流程”,回家后不必固守这个“点”。
在北方冬天的农村,很多老人仍然是“日落而息”,告诉他不用等到“深更半夜”就可以注射那针胰岛素的时候,那微笑是出自内心的。
第一,速效胰岛素:
- 这类胰岛素在临床上应用的比较广泛,是近些年比较普遍用于餐后血糖的控制,往往是在餐前皮下注射,起效的时间大约是 10—15 分钟左右,这类胰岛素临床上最常用的包括:门冬胰岛素注射液、赖脯胰岛素注射液等。
第二,短效胰岛素:
- 同样适用于餐后血糖的控制,起效时间是 15—60 分钟左右,这类胰岛素在临床上主要包括:重组人胰岛素 R、生物合成人胰岛素 R 等。
第三,中效胰岛素:
- 临床上最常用的就是 NPH,起效时间是 2.5—3 个小时左右, 峰值出现是在 5—7 小时左右,作用时间为 13-16 小时左右。
第四,长效胰岛素:
- 临床上最常用的就是 PZI,起效时间是 3—4 个小时左右, 峰值出现是在 8—10 小时左右,作用时间可长达 20 小时左右。
第五,超长效胰岛素:
- 也是临床上目前最常用的,包括甘精胰岛素注射液、地特胰岛素注射液,作用时间可达 24 小时,是目前长效胰岛素比较稳定的一种。
第六,预混胰岛素:
- 这类胰岛素种类有很多,其中包括诺和灵 30r、诺和灵 50r、诺和锐 30、诺和锐 50、优泌乐 25、优泌乐 50、优泌林 70/30、甘舒霖 30/70 等等。
胰岛素虽然是非常有效的降糖药物,但是在注射胰岛素的过程中也会产生一些不良的反应,而对于胰岛素具体的不良反应有哪些?大致有以下几个方面。
第一,胰岛素过量导致的不良反应:最主要的就是低血糖的发生,而严重的低血糖会导致休克甚至死亡,临床上常见的症状包括饥饿感明显、精神不安、脉搏加快、瞳孔散大、焦虑紧张、头晕头痛、共济失调、震颤、昏迷等等。这时应该迅速补充葡萄糖来缓解低血糖,并且寻找医生调整胰岛素方案,适当的减少胰岛素的用量。
第二,在局部注射胰岛素时:由于操作不当或者皮肤比较敏感,也会出现皮肤泛红、皮下出现硬结节、长期注射导致皮下皮肤组织和脂肪萎缩,这时需要去医院在医生和护士的指导下正确使用胰岛素笔注射,是否需要更换注射的部位要在医生的指导下进行,皮下注射胰岛素极少数患者会发生皮疹以及荨麻疹的发生,如果出现过敏性休克应该给予肾上腺素抢救治疗。
第三,也有极少数的患者会对胰岛素产生耐受性:每天需要胰岛素的量特别大,甚至高达 200 单位以上,这时需要在医生的指导下考虑换用其他种类的制剂或者加用口服药,还有一部分人是对胰岛素产生心理上的恐惧,注射胰岛素的过程中会出现焦虑、紧张、心慌、气短甚至昏厥等症状,这时需要自身调整和在医生给予心理上的指导,症状可得到缓解。

胰岛素是一种蛋白质激素,温度过高或过低都会使其变性而失效。适宜的储存温度能够保证胰岛素的药效。
未开启的胰岛素应保存在 2℃至 8℃的冰箱中,并在保质期前使用。此外,从冰箱里拿出来的未开启的胰岛素不要立即开启使用,需在室温下放置 60 分钟左右,让胰岛素的温度恢复到常温时再使用,低温胰岛素注射时容易引起疼痛。
提醒:切记不要把胰岛素放在冰箱的冷冻层,结冰的胰岛素由于温度低会发生变性而失效,更不能为了避免浪费而将已经结冻的胰岛素解冻使用。已开启的胰岛素应注明开启时间,并在室温阴凉处存放,不超过 30℃(如置于橱柜里或阴凉处),在 4 周内用完。
如果需要长途携带,可将胰岛素装在专用的盒子里,到达目的地后再放入冰箱中冷藏。在运输过程中不能剧烈震动,因为胰岛素的分子结构是由两条氨基酸链通过两条二硫键松散的连接在一起,在剧烈震动的情况下,二硫键会出现断裂,从而破坏其生物活性,导致药效丧失。
根据《中国民航总局关于限制携带液态物品乘坐民航飞机的公告》,糖尿病患者携带必需的液态药品,经安全检查确认无疑后,可适量携带。出行之前最好根据自己此次出行的天数,算一下所需的胰岛素量,尽量不要带太多。此外,托运行李舱内的温度和客舱的温度是有很大差别的,胰岛素经过托运很有可能导致失效,所以一定要将胰岛素随身携带。
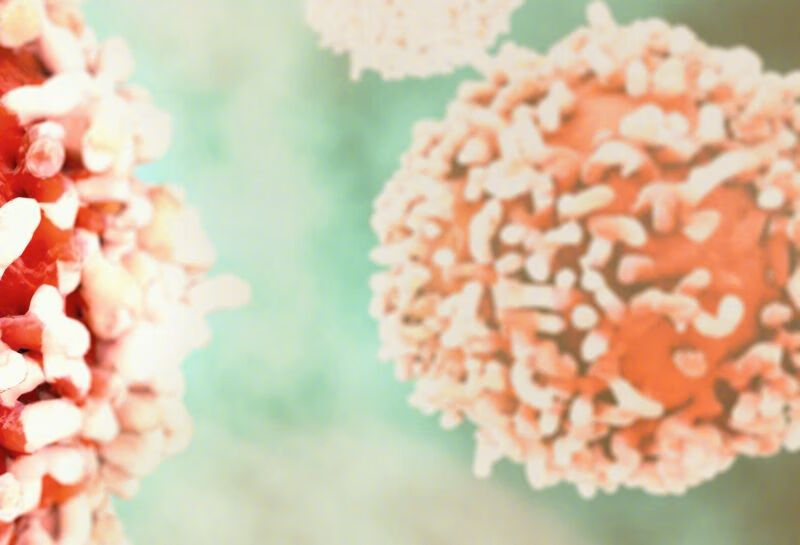
病症: 胃癌 恶性黑色素瘤
患者:李女士
年龄:70岁
病症: 胃癌 恶性黑色素瘤
患者:李女士
年龄:70岁
罹患癌症,毫无疑问对每个人都是重大打击。而如果一位患者不幸同时罹患两种癌症,我们可以想象得出他的心情会是怎样的沉重。
但时至今日,癌症早已不再是什么“不治之症”,很多良好的治疗方法,可帮助患者迈过重重困境,预后得到极大提升。
不仅如此,在医疗全球化的今天,中国患者也能通过“海外二诊”服务,快速触达到国际权威专家资源,为自己的治疗保驾护航!
今天的案例主人公李女士,正是一位“海外二诊”的受益者。我们来一起看看她的故事。*为保护隐私,文中患者个人信息均已经脱敏处理。
70岁的李女士在去年年底,因脚底疼痛去医院看病,结果发现脚后跟有一个1厘米的黑色肿物。医生判断是冻疮,于是开了点外用药,李女士也就没有再放在心上。
大概4个月后,真正的噩梦降临:李女士通过影像检查,被诊断为胃癌,而且有了淋巴结转移。 她还出现了多次呕血,病情非常危急。很快,医生为她实施了全胃切除。令人意想不到的是,几天后通过检查,医生发现李女士后脚跟的肿物竟然也是癌症——恶性黑色素瘤。于是大概2个月后,医生又切除了她的足底肿瘤。
为了降低复发风险,李女士开始了3个周期的化疗联合免疫治疗(替吉奥联合纳武单抗)。
虽然该做的都已做完,但对于李女士来说,恐惧感还远未被消除。因为癌症最令人恐惧的,是其具有“复发转移”的能力 。一旦癌症再次袭来,李女士不知道自己该如何应对。另外,两种癌症的治疗以及术后辅助药物治疗,也让李女士遭遇了一些副作用。比如腹泻、味觉障碍还有体重明显下降的问题。这些对于已经70岁的李女士来说,都很影响生活质量,所以迫切需要解决。
在本次的国际专家“海外二诊”服务中,李女士预约的是来自日本某知名综合性医院肿瘤中心的外科部长医生,他的专长领域既包括肿瘤外科,又包括各类癌症药物疗法、姑息治疗,是一位“内外兼修”的权威专家。在充分了解了李女士既往的病情和治疗经过后,医生很快通过远程会诊的方式,为患者详细解答了当前她的所有问题。
1、 未来如果转移或复发了该怎么办?
医生:假如您未来不幸出现转移或复发,那么化疗是核心治疗手段。对于单发的孤立转移灶,可以选择手术、放疗来进行局部治疗。
具体化疗方案选择,我按使用的先后顺序列出了3类,当前面的方案失效后,可更换为后面的方案。
一类方案:化疗联合/不联合免疫方案
- CAPOX (卡培他滨+奥沙利铂)±O药(即免疫药物纳武单抗)
- SOX (替吉奥+奥沙利铂)±O药
- FOLFOX (5-FU+奥沙利铂)±O药
二类方案:化疗联合/不联合抗血管药物方案
- Taxane (紫杉醇/白蛋白结合型紫杉醇/多西紫杉醇)±雷莫芦单抗
三类方案:化疗方案
- 曲氟尿苷/盐酸替吡嘧啶
- 伊立替康
2、N K细胞疗法是否对我有帮助?副作用是否可控? X医生:目前尚没有证据表明NK细胞疗法对癌症有效,因此不予推荐。
3、口服替吉奥会腹泻,是否需要调整方案? II/III期胃癌患者术后采用辅助治疗方案,分别为:
- 替吉奥口服 1 年(口服 4 周,停药 2 周,共 8 个疗程或口服 2 周,停药 1 周,共 16个疗程)
- CAPOX (卡培他滨+奥沙利铂) 共半年(每 3 周一次,共 8 个疗程)
- SOX (替吉奥+奥沙利铂) 共半年(每 3 周一次,共 8 个疗程)
这三种方案中,替吉奥方案和CAPOX方案等效,但SOX要优于替吉奥。另外,胃癌术后直接使用纳武单抗免疫治疗无意义。
替吉奥确实会出现腹泻等代表性不良反应,患者可以考虑对症治疗,比如调节肠道的药物、止泻药等缓解副作用。如果副作用太严重,那么可以考虑减少药物剂量。
替吉奥的标准用药剂量为120mg,但用量低于80mg无法达到预期效果。如果当前患者用药为100mg,那么为了降低副作用,可以减少剂量到80mg;但如果目前剂量已经是80mg,则无法进一步降低剂量,此时考虑更换方案为CAPOX方案替代。 如果不良反应严重到干扰日常生活,则患者可以选择停药,持续观察病情变化。
对于无淋巴结转移的II期B和II其C的患者,可选择使用1年帕博丽珠单抗免疫治疗。
4 、术后患者很瘦,味觉障碍,如何调理改善? 通常,手术后患者体重会减轻20%左右。这是患者消化吸收能力低下、促食欲的胃肠激素减少引起的。大约6个月到1年时间,患者可以恢复正常。
味觉障碍可能是抗癌药的副作用引起的,也可能是饮食减少导致缺乏锌等微量元素引起的。建议患者采用少食多餐的方式饮食,每天分5-6次吃饭。在日本,我们有时也会给患者用一些营养补充剂。
另外,也可以考虑采用中草药的对症治疗,改善症状,比如十全大补汤、六君子汤。 会诊结束后,李女士的心情得到了极大的平复。她对自己未来要走的路更清晰了,也对日本专家的细致指导和会诊的快速响应非常满意。
中国是消化道癌症发病数量较多的国家,根据国家癌症中心发布的《2022年中国恶性肿瘤疾病负担情况》数据,2022年我国胃癌新发病例约为35.87万例,死亡人数26.04万人。
总体来说,胃癌属于严重威胁我国国民生命健康的蕞常见癌症之一。胃癌如能在早、中期发现,还是有很大机会通过手术实现根治的,患者仍有一定机会得到临床治愈(术后5年不复发即为临床治愈)。
但在胃癌患者中,一部分人会因为【年龄较高】、伴有诸多【基础病】等问题,对手术存有疑虑,担心“下不来手术台”,甚至会放弃手术机会,选择吃药等姑息治疗。这样的选择真的正确吗?现如今的技术能否支持这类老年患者安全手术呢?接下来,我们一起看一个真实案例。
01七旬老人遭遇中期胃癌
一位七十多岁的“老胃病”项女士,因短时间体重骤降(8斤)前往就医。血液检测显示,她有一项指标异常升高。进一步检查发现,她的食道和胃连接的地方(贲门)以及胃的“外墙”(胃壁)都变得异常的厚,而且形状不均匀——这正是胃癌常见的表现。
医生随后通过胃镜检查和病例活检(取一小块组织观察上面的细胞),确诊了老人患有胃癌。由于还没有出现胃以外的远处其他器官的转移,也没有附近淋巴结转移,因此项女士的胃癌分期为中期。虽不是早期,但中期胃癌通常是可以手术的。为项女士提供诊疗的医生也表示,可以通过全胃切除手术实现根治。
但一来项女士已经七十多岁,二来她有20多年的糖尿病(手术伤口会更慢愈合、感染风险高、术后并发症风险高)、右肺还有一枚1.2厘米的肺结节。种种问题让老人和家人们都比较犹豫,担心扛不住治疗,最终“越治越糟”。在这样的背景下,项女士决定找一位足够权威的外科专家,来为自己进行全面评估,看看能不能兼顾好肿瘤根治以及手术的安全性。
不久后,项女士预约了来自日本癌研有明医院消化中心胃外科部长布部创也医生为自己提供指导。
02日本专家咨询内容分享
在充分了解了项女士的病情信息和全部资料后,布部创也医生给出了如下指导建议:首先,患者此前接受的是普通CT而非增强CT,胃镜也没有清晰展示食道上肿瘤具体侵犯的程度,因此很难得出精准的分期判断。
后面患者来癌研有明医院就医时,医疗团队会在治疗前为她做一套非常精细、全面的检查,此后就可以明确肿瘤情况了。届时如果发现患者的分期、肿瘤侵犯的范围确实和现在的结果相同,那么可以通过一个腹腔镜微创手术实现根治,损伤会非常小;如果届时发现肿瘤侵犯食道过多,则需要消化道联合食道外科共同进行胸腔镜手术治疗。
但无论是哪一种情况,患者都可以耐受手术,并且保留一部分胃。癌研有明医院是一家极为擅长肿瘤微创手术的知名癌症专科医院。在胃癌方面,2005年,医院开始导入腹腔镜,2019年又引入了达芬奇手术机器人,患者术后并发症更少了。如今,癌研有明医院98%的外科手术都采用微创。
受益于此,很多在别的医院需要胃全切的胃癌患者,到癌研有明后可以保留一部分胃,还能兼顾临床治愈。这对于术后患者的长期营养摄入和体重维持都很有帮助。布部创也医生所在科室的主要目标之一,正是在做到根治性切除的前提之下,将原本的胃全切术式变为次全胃切除术,尽可能为患者保留一些胃,让他们未来的生活质量得到提升。
那么项女士的糖尿病问题,会不会影响到手术呢?对此,布部创也医生认为完全不必担心,因为对于这类患者,癌研有明医院会进行详细的术前评估,并且有专业团队介入,从生活方式调整和专业治疗入手,帮助患者控制好血糖,让血糖水平达到符合手术的标准,从而降低术后愈合不良风险。
关于肺部的1.2厘米结节,布部医生认为可以暂不处理,无论它到底是良性还是恶性。因为这枚结节属于纯磨玻璃结节,即便是恶性,进展也非常缓慢,并不会快速出现转移扩散。而胃癌根治手术虽然会采用微创方式,但依然会给患者带来一定的负担,如果同时处理肺结节,会导致负担过重、患者难以承受。所以当前蕞好的处理办法,是先集中精力解决胃癌肿瘤,术后安排呼吸科专家为患者进行肺结节诊断,给出随访或手术或根治性放疗的建议。
03项女士术后,是否需要化疗来降低复发风险、争取更大治愈希望?
对此,布部创也医生表示,是否化疗现在还不能判断。因为术后患者能获得蕞精准的分期判断,有可能患者术前被认为是2期,但实际上术后成了1期(无需化疗);有时也可能患者术前是1期,但术后成了2-3期。假如是2-3期,则患者术后需要坚持1年的辅助化疗,大概可以降低10%的复发风险。
当地时间10月29日礼来宣布了Ⅲb期临床试验(TRAILBLAZER-ALZ 6)的积极结果,对于早期症状性阿尔茨海默病成人患者,用改良滴定方案接受donanemab治疗的患者在24周主要终点时,伴水肿/积液的淀粉样蛋白相关影像学异常(ARIA-E)有所减少。
donanemab这个新药在今年7月获批于美国,又在之后获日本厚生劳动省、英国药品和医疗产品监管局批准,用于轻度阿尔茨海默病、轻度认知功能障碍的治疗。donanemab在国内2023年取得突破性治疗药物认定,并纳入优先审评审批程序,目前还在审评审批过程中。
 CDE官网截图
CDE官网截图
但在FDA说明书中有黑框警告,大意是应用该药时应注意淀粉样蛋白相关影像学异常(ARIA),表现为ARIA-E和ARIA伴含铁血黄素沉积(ARIA-H),通常发生在治疗早期,且无症状,很少发生严重和危及生命的事件。本次试验的积极结果和这个黑框警告相关。一起来看详情。

FDA说明书截图
给药方式有哪些改变?会不会影响效果?
TRAILBLAZER-ALZ 6是一项多中心随机双盲Ⅲb期研究,主要研究donanemab的不同给药方案对早期症状性AD患者ARIA-E和淀粉样蛋白清除率的影响,这里的早期AD指的是轻度认知障碍(MCI)和轻度痴呆疾病阶段。

给药方式和既往不同,既往标准给药方案是在前三次输注时接受2瓶(700mg)donanemab,然后再接受4瓶(1400mg);改良滴定方式是患者第一次输注1瓶(350mg),第二次输注2瓶(700mg),第三次输注3瓶(1050mg),此后每次输注4瓶(1400mg)。
研究的主要终点是第24周时患者出现ARIA-E占总参与者的比例,结果显示接受改良滴定方式的患者ARIA-E发生率为14%,而标准给药方案为24%,相对风险降低41%。载脂蛋白E(APOE)是已知的阿尔茨海默病遗传风险因素的携带者,在这些患者中,19%患者在改良滴定时患有ARIA-E,而标准给药方案中为57%,相对风险降低67%。
看到这里你或许也有疑问,虽然ARIA-E的发生风险降低了,但改良滴定方案会不会影响疗效?答案是不会。
与接受标准给药方案的患者相比,改良滴定患者淀粉样斑块和p-tau217减少。改良滴定的患者的淀粉样斑块水平较基线平均降低 67%,而标准给药组患者为69%。
参考来源
1.Modified Titration of Donanemab Demonstrated Reduction of ARIA-E in Early Symptomatic Alzheimer's Disease Patients in Phase Ⅲb study.
2.CED官网.
3.A Study of Different Donanemab (LY3002813) Dosing Regimens in Adults With Early Alzheimer's Disease (TRAILBLAZER-ALZ 6).
当地时间10月29日,阿西米尼(asciminib)获美国食品药品管理局(FDA)加速批准[1] ,用于慢性期新诊断的费城染色体阳性慢性粒细胞白血病(Ph+CML)成年患者。CML是一种骨髓和血细胞癌症,通常由费城染色体的异常染色体引起。在一线治疗中,约1/3的患者会出现下列问题:由于不良反应或者治疗无效而停止酪氨酸激酶抑制剂(TKI)治疗。
为了解决这一问题,需要开发新的药物,asciminib就是解决这一困境的新药。早在2022年8月,加拿大药物和卫生技术局(CADTH)建议[2] :“若满足条件,可通过公共药物计划报销asciminib用于治疗费城染色体阳性慢性粒细胞白血病。”
asciminib为何得到FDA的青睐?
本次获批基于一项III期多中心随机研究,研究目的是比较每日80mg的asciminib与TKI治疗的疗效。TKI治疗是接受伊马替尼、尼洛替尼、达沙替尼或博舒替尼任意一种治疗。
共有405名患者被随机分配(1:1)进两组治疗。主要疗效结局指标是48周时的主要分子反应(MMR)率。这个指标是慢性髓性白血病的关键指标,这个比例越高,说明该治疗在基因水平上对疾病的控制效果越好,能够更有效地抑制疾病相关基因的表达,进而有望更好地控制疾病的进展、改善患者的症状和预后。
研究结果显示,48周时MMR率方面,asciminib组中为68%(95% CI: 61, 74),TKI组为49%(95% CI: 42, 56),二者相差19%。细看具体的TKI,入组伊马替尼和其他TKI药物入组比例为1:1;asciminib组的MMR率为69%(95% CI: 59, 78),而伊马替尼组为40%(95% CI: 31, 50),相差近30%(95% CI: 17, 42)。
这个新药安全吗?每周需要打几次药?
根据FDA数据显示,在新诊断和既往接受过治疗的患者,应用新药最常见的不良反应(≥20%)是肌肉骨骼疼痛、皮疹、疲劳、上呼吸道感染、头痛、腹痛和腹泻。若只看新诊断的患者,最常见的实验室异常(≥40%)是淋巴细胞计数降低、白细胞计数降低、血小板计数降低、中性粒细胞计数降低等。
根据FDA已批准的asciminib说明书,用药期间还需要注意一下事项:
1.骨髓抑制 :用药期间可能因出现骨髓抑制,发生血小板减少症、中性粒细胞减少症和贫血。用药应在治疗的前3个月,需要每两周进行一次全血细胞计数,此后每月进行一次检测,从而判断患者有无骨髓抑制症状。根据严重程度,咨询医生是否需要停药。
2.胰腺毒性 :患者可能出现血清脂肪酶和淀粉酶无症状升高,每月需评估血清脂肪酶和淀粉酶水平,如果您有胰腺炎,则注意主动告知医生,需要进行频率更高的检测。
3.高血压风险 :可能出现3级或4级高血压风险,应注意检测血压。
4.超敏反应 :可能出现3级或4级超敏反应,包括皮疹、水肿和支气管痉挛。如果出现这些症状,需及时反馈医生,医生会根据超敏反应的体征和症状,开始适当的治疗。
5.心血管毒性 :如果您有心血管病史,需要告知医生;对于3级或更高级别的心血管毒性,医生会考虑暂停用药、减少剂量或永久停药。
6.胚胎/胎儿毒性 :若您在怀孕期间用药或在服用药物期间怀孕,可能对孩子有潜在风险。这个新药是口服药,需要根据不同的给药剂量(80mg或40mg)每天/或每两天用药。
近些年来,还有哪些白血病药物获批FDA?
根据FDA肿瘤学/血液系统恶性肿瘤批准通知,白血病相关新药整理如下表。
另外可以看出21年时asciminib已获批白血病治疗,但限定既往接受过两种或更多TKIs治疗,本次获批属于扩大适应证。

参考来源:
1.FDA grants accelerated approval to asciminib for newly diagnosed chronic myeloid leukemia. 2.Asciminib(Scemblix):CADTHReimbursementRecommendation:Indication:ForthetreatmentofadultpatientswithPhiladelphiachromosome-positivechronicmyeloidleukemia(Ph+CML)inchronicphase(CP)previouslytreatedwith2ormoretyrosinekinaseinhibitors.Ottawa(ON):CanadianAgencyforDrugsandTechnologiesinHealth;2022Aug.PMID:38713779. 3.AStudyofOralAsciminibVersusOtherTKIsinAdultPatientsWithNewlyDiagnosedPh+CML-CP. 4.Product information:SCEMBLIX-asciminibtablet,filmcoated.UpdatedAugust7,2024. 5.Oncology(Cancer)/HematologicMalignanciesApprovalNotifications.

以下内容来源于新英格兰医学杂志。
Presentation of Case

Differential Diagnosis
Movement Disorders
Seizures
Functional Movement Disorder
Dyskinesia
Limb-Shaking TIAs
Clinical Impression and Initial Management

Clinical Diagnosis
Dr. Albert Y. Hung’s Diagnosis
Pathological Discussion

Pathological Diagnosis
Additional Management
Final Diagnosis

以下内容来源于新英格兰医学杂志。
Presentation of Case
Dr. Christine M. Parsons (Medicine): A 75-year-old woman was evaluated at this hospital because of arthritis, abdominal pain, edema, malaise, and fever.
Three weeks before the current admission, the patient noticed waxing and waning “throbbing” pain in the right upper abdomen, which she rated at 9 (on a scale of 0 to 10, with 10 indicating the most severe pain) at its maximal intensity. The pain was associated with nausea and fever with a temperature of up to 39.0°C. Pain worsened after food consumption and was relieved with acetaminophen. During the 3 weeks before the current admission, edema developed in both legs; it had started at the ankles and gradually progressed upward to the hips. When the edema began to affect her ambulation, she presented to the emergency department of this hospital.
A review of systems that was obtained from the patient and her family was notable for intermittent fever, abdominal bloating, anorexia, and fatigue that had progressed during the previous 3 weeks. The patient reported new orthopnea and nonproductive cough. Approximately 4 weeks earlier, she had had diarrhea for several days. During the 6 weeks before the current admission, the patient had lost 9 kg unintentionally; she also had had pain in the wrists and hands, 3 days of burning and dryness of the eyes, and diffuse myalgias. She had not had night sweats, dry mouth, jaw claudication, vision changes, urinary symptoms, or oral, nasal, or genital ulcers.
The patient’s medical history was notable for multiple myeloma (for which treatment with thalidomide and melphalan had been initiated 2 years earlier and was stopped approximately 1 year before the current admission); hypothyroidism; chikungunya virus infection (diagnosed 7 years earlier); seropositive erosive rheumatoid arthritis affecting the hands, wrists, elbows, and shoulders (diagnosed 3 years earlier); vitiligo; and osteoarthritis of the right hip, for which she had undergone arthroplasty. Evidence of gastritis was reportedly seen on endoscopy that had been performed 6 months earlier. Medications included daily treatment with levothyroxine and acetaminophen and pipazethate hydrochloride as needed for cough. The patient consumed chamomile and horsetail herbal teas. She had no known allergies to medications, but she had been advised not to take nonsteroidal antiinflammatory drugs after her diagnosis of multiple myeloma.
Approximately 5 months before the current admission, the patient had emigrated from Central America. She lived with her daughter and grandchildren in an urban area of New England. She had previously worked in health care. She had no history of alcohol, tobacco, or other substance use. There was no family history of cancer or autoimmune, renal, gastrointestinal, pulmonary, or cardiac disease.
On examination, the temporal temperature was 37.1°C, the heart rate 106 beats per minute, the blood pressure 152/67 mm Hg, and the oxygen saturation 100% while the patient was breathing ambient air. She had a frail appearance and bitemporal cachexia. The weight was 41 kg and the body-mass index (the weight in kilograms divided by the square of the height in meters) 15.2. Her dentition was poor; most of the teeth were missing, caries were present in the remaining teeth, and the mucous membranes were dry. She had abdominal tenderness on the right side and mild abdominal distention, without organomegaly or guarding. Bilateral axillary lymphadenopathy was palpable. Infrequent inspiratory wheezing was noted.
The patient had swan-neck deformity, boutonnière deformity, ulnar deviation, and distal hyperextensibility of the thumbs (Fig. 1). Subcutaneous nodules were observed on the proximal interphalangeal joints of the second and third fingers of the right hand and on the proximal interphalangeal joint of the fourth finger of the left hand. Synovial thickening of the metacarpophalangeal joints of the second fingers was noted. There was mild swelling and tenderness of the wrists. She had pain with flexion of the shoulders and right hip, and there was subtle swelling of the shoulders and right knee. Pitting edema (3+) and vitiligo were noted on the legs. No sclerodactyly, digital pitting, telangiectasias, appreciable calcinosis, nodules, nail changes (including pitting), or tophi were present. The remainder of the examination was normal.

The blood levels of glucose, alanine aminotransferase, aspartate aminotransferase, bilirubin, globulin, lactate, lipase, magnesium, and phosphorus were normal, as were the prothrombin time and international normalized ratio; other laboratory test results are shown in Table 1. Urinalysis showed 3+ protein and 3+ blood, and microscopic examination of the sediment revealed 5 to 10 red cells per high-power field and granular casts. Urine and blood were obtained for culture. An electrocardiogram met (at a borderline level) the voltage criteria for left ventricular hypertrophy.

Dr. Rene Balza Romero: Computed tomography (CT) of the chest, abdomen, and pelvis, performed after the intravenous administration of contrast material, revealed scattered subcentimeter pulmonary nodules (including clusters in the right middle lobe and patchy and ground-glass opacities in the left upper lobe), trace pleural effusion in the left lung, coronary and valvular calcifications, and trace pericardial effusion, ascites, and anasarca. The scans also showed slight enlargement of the axillary lymph nodes (up to 11 mm in the short axis) bilaterally and a chronic-appearing compression fracture involving the T12 vertebral body.
Dr. Parsons: Morphine and lactated Ringer’s solution were administered intravenously. On the second day in the emergency department (also referred to as hospital day 2), the blood levels of haptoglobin, folate, and vitamin B12 were normal; other laboratory test results are shown in Table 1. A rapid antigen test for malaria was positive. Wright–Giemsa staining of thick and thin peripheral-blood smears was negative for parasites; the smears also showed Döhle bodies and basophilic stippling. Antigliadin antibodies and anti–tissue transglutaminase antibodies were not detected. Tests for hepatitis A IgG and hepatitis C antibodies were positive. Tests for hepatitis B core and surface antibodies were negative. A test for human immunodeficiency virus type 1 (HIV-1) and type 2 (HIV-2) was negative.
Findings on abdominal ultrasound imaging performed on the second day (Fig. 2A and 2B) were notable for a small volume of ascites and kidneys with echogenic parenchyma. Ultrasonography of the legs showed no deep venous thrombosis. An echocardiogram showed normal ventricular size and function, aortic sclerosis with mild aortic insufficiency, moderate tricuspid regurgitation, a right ventricular systolic pressure of 39 mm Hg, and a small circumferential pericardial effusion. Intravenous hydromorphone was administered, and the patient was admitted to the hospital.

On the third day (also referred to as hospital day 3), nucleic acid testing for cytomegalovirus, Epstein–Barr virus, and hepatitis C virus was negative, and a stool antigen test for Helicobacter pylori was negative. An interferon-γ release assay for Mycobacterium tuberculosis was also negative. Oral acetaminophen and ivermectin and intravenous hydromorphone and furosemide were administered.
Dr. Balza Romero: Radiographs of the hands (Fig. 2C through 2F) showed joint-space narrowing of both radiocarpal joints and proximal interphalangeal erosions involving both hands. Radiographs of the shoulders showed arthritis of the glenohumeral joint and alignment suggestive of a tear of the right rotator cuff. A radiograph of the pelvis showed diffuse joint-space narrowing of the left hip, without osteophytosis, and an intact right hip prosthesis.
Dr. Parsons: Diagnostic tests were performed, and management decisions were made.
Differential Diagnosis
Cancer
Infectious Disease
Autoimmune Disease
Hypocomplementemia
Dr. Beth L. Jonas’s Diagnosis
Pathological Discussion
Pathological Diagnosis
Discussion of Management
Follow-up
Final Diagnosis
Overlap syndrome of rheumatoid arthritis and systemic lupus erythematosus complicated by proliferative lupus nephritis, superimposed on amyloid A amyloidosis.
展开更多















