简称:
临泉骨伤医院,成立于2011年,位于安徽省阜阳市,业务范围是“内科门诊、中医骨伤科、中医康复理疗科、中医内科、检验科(临床生化检验专业、临床血液)、医学影像科(X线诊断、超声检查、心电诊断专业)机构养老服务”。该社会组织注册资金50万人民币。
-
 气胸在临床上是比较多见的,一般是属于内科疾病,但是由于创伤导致的气胸可以就诊于胸外科积极治疗。常见的症状有呼吸困难,胸闷,可伴有咳嗽,冷汗,心律失常,意识不清等。在临床上,创伤性气胸是比较多见的,一般是由于肋骨骨折或者异物刺穿胸膜腔而导致的。对于临床上出现创伤性气胸,首先需要判断气胸的分类,一般可以分为单纯性气胸,开放性气胸,高压性气胸。对于单纯性气胸,需要根据气体的量来选择治疗方式,对于小量的气胸可以保守治疗,嘱其严格卧床休息,给予止痛、镇静等对症治疗,同时治疗外部创伤。对于气体量较大的,可以选择进行胸腔穿刺抽气或者胸腔闭式引流来减轻患者的临床症状。如果患者属于开放性气胸或者高压性气胸,首先需要将开放性气胸的创口封闭,然后再给予胸腔闭式引流等对症治疗来控制患者气胸的发展。对于由于支气管创伤引起的,可以采用支气管微球或者栓子堵塞支气管来改善气胸的症状。还有一部分患者虽然经过内科的积极治疗,但是气胸的症状并没有得到缓解,可以选择进行外科手术治疗,特别是适用于双侧气胸或者张力性气胸有多发多处骨折的患者。总之,临床上对于出现创伤性气胸,首先要明确气胸的类型,然后再根据患者的临床症状来选择合适的治疗方式,尽早的控制病情的发展。
气胸在临床上是比较多见的,一般是属于内科疾病,但是由于创伤导致的气胸可以就诊于胸外科积极治疗。常见的症状有呼吸困难,胸闷,可伴有咳嗽,冷汗,心律失常,意识不清等。在临床上,创伤性气胸是比较多见的,一般是由于肋骨骨折或者异物刺穿胸膜腔而导致的。对于临床上出现创伤性气胸,首先需要判断气胸的分类,一般可以分为单纯性气胸,开放性气胸,高压性气胸。对于单纯性气胸,需要根据气体的量来选择治疗方式,对于小量的气胸可以保守治疗,嘱其严格卧床休息,给予止痛、镇静等对症治疗,同时治疗外部创伤。对于气体量较大的,可以选择进行胸腔穿刺抽气或者胸腔闭式引流来减轻患者的临床症状。如果患者属于开放性气胸或者高压性气胸,首先需要将开放性气胸的创口封闭,然后再给予胸腔闭式引流等对症治疗来控制患者气胸的发展。对于由于支气管创伤引起的,可以采用支气管微球或者栓子堵塞支气管来改善气胸的症状。还有一部分患者虽然经过内科的积极治疗,但是气胸的症状并没有得到缓解,可以选择进行外科手术治疗,特别是适用于双侧气胸或者张力性气胸有多发多处骨折的患者。总之,临床上对于出现创伤性气胸,首先要明确气胸的类型,然后再根据患者的临床症状来选择合适的治疗方式,尽早的控制病情的发展。 -
 提起慢性乙肝,不少人都是一脸愁容。因为慢性乙型肝炎最深入人心的特点可能就是难以根治了。抽血检查提示 HBsAg 和(或)乙肝病毒 DNA 阳性 6 个月以上即为慢性乙型肝炎。医学发展到现在还是没有办法完全清除乙肝病毒、治愈慢性乙型肝炎,这让慢性乙肝成了很多患者头顶挥之不去的阴霾。但是需要了解的一点是,根据病情及个体不同,慢性乙肝是可以控制的,甚至是可以携带病毒正常生活、终身不复发的。那么,面对慢性乙型肝炎该怎么办?不要轻信江湖偏方最重要的提醒放在前面,目前仅有的、经批准的正规抗病毒药物是干扰素和核苷类药物,再加上还原型谷胱甘肽、联苯双酯滴丸和熊去氧胆酸等改善肝功能的药物。其他「秘方」,无论冠之多么高大上的名字,都是没有证据证明其有效的。工作中,没见过被这些神药控制住病情的,反倒是见过十好几个因为用了秘方,把自己整成药物性肝炎,甚至暴发性肝衰竭的病人。曾经流传过的「细胞疗法」等所谓高科技,所谓专家教师倒是也能头头是道的从病毒细胞讲到免疫系统,但大多即使能从理论上推理出疗效,也没有任何可靠文献和临床证据。更别说,其中多数药物的机制,懂行的人一眼就能看出站不住脚,是在忽悠病人和家属。患上乙肝,去正规医院接受正规治疗,才是正道。莫轻信广告。哪些人需要治疗?乙肝两对半中病毒表面抗原阳性时,代表体内存在乙肝病毒。但不能仅凭这项指标来决定是否需要治疗。慢性乙肝的用药需要考虑的因素比较多,如何治疗、怎么用药,医生会根据各项检查结果,综合考量。存在异常指标的乙肝患者自然是需要治疗的,其中除了常见的肝功能指标,HBV DNA 也是非常重要的一部分,这其中又根据具体病情有几种不同的情况:最常见的轻度肝功能异常,比如肝酶升高较多的,需要及时到正规医院测定病毒 DNA ,医生会根据病毒的活跃程度考虑是否需要进行抗病毒治疗;若发生乙肝病毒引起的重症肝炎,先稳定肝脏情况,度过危险期后再进行抗病毒治疗;当发现存在肝硬化时,如果同时乙肝病毒 DNA ≥ 2000IU/ml,那么无论肝酶数量多少都建议抗病毒治疗。慢性乙肝的治疗目标临床上,慢性乙型肝炎的治疗目标,是最大限度地、长期抑制乙肝病毒增多,维持正常的肝功能,减轻肝细胞炎症及纤维化,延缓其他相关并发症的发生,从而改善生活质量和延长生存时间。慢性乙型肝炎的病人用药不宜过多过杂,因为药物都需要经过肝脏代谢,用药过多过杂,反而可能会增加肝脏负担。除此以外,虽然肝酶升高是乙肝治疗的指标,但是治疗乙肝的目的却不只是降低肝酶。护肝降酶的药物只是辅助治疗,控制乙肝病毒才是重点,可别舍本逐末追求降低血清转氨酶而忘了正规抗病毒了。故建议在医生指导下合理用药,不要擅自加药、换药、停药。病毒携带者需要注意什么?肝功正常的乙肝病毒携带者,严格来说并不是病人。乙肝病毒对肝脏的破坏并不是直接来自病毒本身,而是病毒感染后,使得自身免疫系统错乱,发动对自身肝脏的攻击。而这些携带者,虽然体内含有病毒,但被感染的肝细胞和自身的免疫系统处于一种和谐平衡的状态。这类人群若盲目用药,有可能打破这种平衡,让肝脏状况变糟。所以通常是不用药,定期复查,监测病情。日常生活中,则需要从以下方面多加注意:改变不良的饮食习惯,营养全面而均衡,拒绝吸烟酗酒;适当参加体育锻炼,并保证休息时间;提高对其他传染性疾病的警惕,积极预防感染;保持健康乐观的心态,让生活多一点乐趣;至少每六个月复查一次肝功能和肝脏 B 超,对健康状况形成连续性的监测。正确面对慢性乙肝目前市场上的抗病毒治疗药物,无论价格还是效果都称不上完美,而且抗病毒药物对肝细胞内已经感染的病毒也不能实现清除和痊愈。但是通过抗病毒治疗,以及必要时的护肝降酶治疗,大多数乙肝患者能够避免走上肝硬化、肝癌的道路,所以这其实也是一种预防。
提起慢性乙肝,不少人都是一脸愁容。因为慢性乙型肝炎最深入人心的特点可能就是难以根治了。抽血检查提示 HBsAg 和(或)乙肝病毒 DNA 阳性 6 个月以上即为慢性乙型肝炎。医学发展到现在还是没有办法完全清除乙肝病毒、治愈慢性乙型肝炎,这让慢性乙肝成了很多患者头顶挥之不去的阴霾。但是需要了解的一点是,根据病情及个体不同,慢性乙肝是可以控制的,甚至是可以携带病毒正常生活、终身不复发的。那么,面对慢性乙型肝炎该怎么办?不要轻信江湖偏方最重要的提醒放在前面,目前仅有的、经批准的正规抗病毒药物是干扰素和核苷类药物,再加上还原型谷胱甘肽、联苯双酯滴丸和熊去氧胆酸等改善肝功能的药物。其他「秘方」,无论冠之多么高大上的名字,都是没有证据证明其有效的。工作中,没见过被这些神药控制住病情的,反倒是见过十好几个因为用了秘方,把自己整成药物性肝炎,甚至暴发性肝衰竭的病人。曾经流传过的「细胞疗法」等所谓高科技,所谓专家教师倒是也能头头是道的从病毒细胞讲到免疫系统,但大多即使能从理论上推理出疗效,也没有任何可靠文献和临床证据。更别说,其中多数药物的机制,懂行的人一眼就能看出站不住脚,是在忽悠病人和家属。患上乙肝,去正规医院接受正规治疗,才是正道。莫轻信广告。哪些人需要治疗?乙肝两对半中病毒表面抗原阳性时,代表体内存在乙肝病毒。但不能仅凭这项指标来决定是否需要治疗。慢性乙肝的用药需要考虑的因素比较多,如何治疗、怎么用药,医生会根据各项检查结果,综合考量。存在异常指标的乙肝患者自然是需要治疗的,其中除了常见的肝功能指标,HBV DNA 也是非常重要的一部分,这其中又根据具体病情有几种不同的情况:最常见的轻度肝功能异常,比如肝酶升高较多的,需要及时到正规医院测定病毒 DNA ,医生会根据病毒的活跃程度考虑是否需要进行抗病毒治疗;若发生乙肝病毒引起的重症肝炎,先稳定肝脏情况,度过危险期后再进行抗病毒治疗;当发现存在肝硬化时,如果同时乙肝病毒 DNA ≥ 2000IU/ml,那么无论肝酶数量多少都建议抗病毒治疗。慢性乙肝的治疗目标临床上,慢性乙型肝炎的治疗目标,是最大限度地、长期抑制乙肝病毒增多,维持正常的肝功能,减轻肝细胞炎症及纤维化,延缓其他相关并发症的发生,从而改善生活质量和延长生存时间。慢性乙型肝炎的病人用药不宜过多过杂,因为药物都需要经过肝脏代谢,用药过多过杂,反而可能会增加肝脏负担。除此以外,虽然肝酶升高是乙肝治疗的指标,但是治疗乙肝的目的却不只是降低肝酶。护肝降酶的药物只是辅助治疗,控制乙肝病毒才是重点,可别舍本逐末追求降低血清转氨酶而忘了正规抗病毒了。故建议在医生指导下合理用药,不要擅自加药、换药、停药。病毒携带者需要注意什么?肝功正常的乙肝病毒携带者,严格来说并不是病人。乙肝病毒对肝脏的破坏并不是直接来自病毒本身,而是病毒感染后,使得自身免疫系统错乱,发动对自身肝脏的攻击。而这些携带者,虽然体内含有病毒,但被感染的肝细胞和自身的免疫系统处于一种和谐平衡的状态。这类人群若盲目用药,有可能打破这种平衡,让肝脏状况变糟。所以通常是不用药,定期复查,监测病情。日常生活中,则需要从以下方面多加注意:改变不良的饮食习惯,营养全面而均衡,拒绝吸烟酗酒;适当参加体育锻炼,并保证休息时间;提高对其他传染性疾病的警惕,积极预防感染;保持健康乐观的心态,让生活多一点乐趣;至少每六个月复查一次肝功能和肝脏 B 超,对健康状况形成连续性的监测。正确面对慢性乙肝目前市场上的抗病毒治疗药物,无论价格还是效果都称不上完美,而且抗病毒药物对肝细胞内已经感染的病毒也不能实现清除和痊愈。但是通过抗病毒治疗,以及必要时的护肝降酶治疗,大多数乙肝患者能够避免走上肝硬化、肝癌的道路,所以这其实也是一种预防。 -
 我们将迎来冬至在《月令七十二候集解》里写到:冬至,十一月中。终藏之气至此而极也。冬至并不是指冬天到了“至”表示极,最古人认为此时阴极之至,阳气始生它有一点物极必反,否极泰来的意思也就是指冬至时天地之间的阴气到达极点,最大但,同时也迎来转机阳气开始复苏萌芽冬至是我们所在的北半球全年中白天最短夜晚最长的一天过了这一天后白天开始慢慢变长夜晚慢慢开始变短所以你也可以把冬至理解为一年中真正的开始老规矩先来看冬至三侯冬至一候:蚯蚓结古人认为蚯蚓是阴曲阳伸的动物冬至时一阳初生阳气刚刚露出个小苗苗此时阴气仍然十分强盛所以地里的蚯蚓依然蜷缩着身体弯弯曲曲像打了结一般冬至二候:麋[mí]角解鹿是山兽属阳糜是水泽之兽属阴此时阳气开始冒头糜感到阳气之后头上的角开始脱落冬至三候:水泉动山中的泉水也感受到阳气的温热冰面之下泉水开始流动从立秋开始天地间的阳热之气开始下沉冬至时阳热降极而升但是阳气升得很微弱微弱到蚯蚓仍蜷曲着身体不能完全舒展开来到二候时麋鹿的角也开始一点点脱落三候时山中的泉水开始一点点流动这说明什么冬至时阴气仍非常强盛,阳气还十分微弱这种状态好比在一片漆黑的房间中只有一根蜡烛在散发着微弱的烛光(阳气)这时候我们应该怎么做?尽量让身边的人和事安静下来以免惊扰到这微弱的烛光(阳气)甚至会用手遮挡在它四周以免它被周围的风吹灭人与天地相应对于人来说也是一样的要尽量让自己心平气和守静养心养阳此时养生应该注意什么呢?一,藏身,藏精,藏汗——静待阳生藏身就是不该露的不露用衣服把自己身体藏起来从冬至开始我们就要进入最冷的三九严寒寒气是最伤阳气的藏精就是能少啪就少啪能不熬夜就不熬夜内经里有句话叫:冬不藏精,春必病温冬天本来就是养精蓄锐的时间我们敛阴护阳还来不及所以要避免过度消耗肾精藏汗就是不该出的汗尽量少出不要过度剧烈大汗淋漓运动因为汗随气出大量流汗的伤阴又伤气这时候要少做惊扰阳气的事情二,冬至后适当养阳前面说了冬至时阴气极重,一阳初生此时阳气很微弱除了藏身,藏精,藏汗我们还可以做一些养阳的事比如常晒背,多泡脚背部是人体的阳中之阳冬天晒晒后背有助于补益身体阳气另外“寒从脚起”冬天泡脚不仅可以温煦双脚还可以帮我们调理体质我曾经有个患者用温胆汤泡脚一个月后整整瘦了六斤她没有做任何运动,没有改变任何饮食为什么?因为温胆汤可以健脾助运可以祛湿,消水肿如果想祛寒湿助阳的话可以用我们的补肾通络包它可以补肾阳,舒筋通络,引火归元祛风、寒湿,活血通络三,谨慎温补冬至仍是进补的好时机但是今年冬至后进补要谨慎温补今年冬天外有寒湿,内有燥热关于这点我之前已经分析过好几次了昨天门诊我就碰到一个8岁的小朋友爷爷说冬天要补一补给他买了白切羊肉吃完后身上发了红疹这个孩子本来就阴虚内热再吃性温的羊肉等于火上浇油热有余就要散全身发红疹就是“散热”的表现切记饮食宜清淡多吃一些滋阴润肺的百合,银耳,石斛不宜过食辛辣燥热,肥腻的食物最后说一下,今天的土木相合,土星、木星、地球连城一线。其实今年3月火星,木星与土星就有黎明时分相遇;10月初,又出现火星冲日;还有10月底,石家庄出现双日同天,11月初时,沈阳天空中出现“三个太阳”11月15日商洛又出现双日。。。庚子年还出现很多自然大事和预言澳大利亚森林大大火,新冠,东非蝗灾,南极出现历史高温,红色积雪,加州大火,9月拉尼娜现象。。。要不要担心那些可怕的预言?木是生命之机,木主仁义,代表观念,伦理;土主信,象征着法度,社会制度,权威木克土,加上庚子年,是会有变革之象子月,对应的本来就是地雷复卦木土变革,在一阳来复的时刻发生,这代表着变革中有净化的力量发生。什么是净化?好的留下,坏的去掉什么是好?什么是坏?老子早就把答案告诉我们了——执大象,天下往无论环境如何,无论经历什么黑暗,天道不改,正道不移与人为善,顺应天道得以善终与人为恶,倒行逆施,私欲者这必将自食恶果坚定这一点信念后正气存内,邪不可干,精神内守,病安从来。
我们将迎来冬至在《月令七十二候集解》里写到:冬至,十一月中。终藏之气至此而极也。冬至并不是指冬天到了“至”表示极,最古人认为此时阴极之至,阳气始生它有一点物极必反,否极泰来的意思也就是指冬至时天地之间的阴气到达极点,最大但,同时也迎来转机阳气开始复苏萌芽冬至是我们所在的北半球全年中白天最短夜晚最长的一天过了这一天后白天开始慢慢变长夜晚慢慢开始变短所以你也可以把冬至理解为一年中真正的开始老规矩先来看冬至三侯冬至一候:蚯蚓结古人认为蚯蚓是阴曲阳伸的动物冬至时一阳初生阳气刚刚露出个小苗苗此时阴气仍然十分强盛所以地里的蚯蚓依然蜷缩着身体弯弯曲曲像打了结一般冬至二候:麋[mí]角解鹿是山兽属阳糜是水泽之兽属阴此时阳气开始冒头糜感到阳气之后头上的角开始脱落冬至三候:水泉动山中的泉水也感受到阳气的温热冰面之下泉水开始流动从立秋开始天地间的阳热之气开始下沉冬至时阳热降极而升但是阳气升得很微弱微弱到蚯蚓仍蜷曲着身体不能完全舒展开来到二候时麋鹿的角也开始一点点脱落三候时山中的泉水开始一点点流动这说明什么冬至时阴气仍非常强盛,阳气还十分微弱这种状态好比在一片漆黑的房间中只有一根蜡烛在散发着微弱的烛光(阳气)这时候我们应该怎么做?尽量让身边的人和事安静下来以免惊扰到这微弱的烛光(阳气)甚至会用手遮挡在它四周以免它被周围的风吹灭人与天地相应对于人来说也是一样的要尽量让自己心平气和守静养心养阳此时养生应该注意什么呢?一,藏身,藏精,藏汗——静待阳生藏身就是不该露的不露用衣服把自己身体藏起来从冬至开始我们就要进入最冷的三九严寒寒气是最伤阳气的藏精就是能少啪就少啪能不熬夜就不熬夜内经里有句话叫:冬不藏精,春必病温冬天本来就是养精蓄锐的时间我们敛阴护阳还来不及所以要避免过度消耗肾精藏汗就是不该出的汗尽量少出不要过度剧烈大汗淋漓运动因为汗随气出大量流汗的伤阴又伤气这时候要少做惊扰阳气的事情二,冬至后适当养阳前面说了冬至时阴气极重,一阳初生此时阳气很微弱除了藏身,藏精,藏汗我们还可以做一些养阳的事比如常晒背,多泡脚背部是人体的阳中之阳冬天晒晒后背有助于补益身体阳气另外“寒从脚起”冬天泡脚不仅可以温煦双脚还可以帮我们调理体质我曾经有个患者用温胆汤泡脚一个月后整整瘦了六斤她没有做任何运动,没有改变任何饮食为什么?因为温胆汤可以健脾助运可以祛湿,消水肿如果想祛寒湿助阳的话可以用我们的补肾通络包它可以补肾阳,舒筋通络,引火归元祛风、寒湿,活血通络三,谨慎温补冬至仍是进补的好时机但是今年冬至后进补要谨慎温补今年冬天外有寒湿,内有燥热关于这点我之前已经分析过好几次了昨天门诊我就碰到一个8岁的小朋友爷爷说冬天要补一补给他买了白切羊肉吃完后身上发了红疹这个孩子本来就阴虚内热再吃性温的羊肉等于火上浇油热有余就要散全身发红疹就是“散热”的表现切记饮食宜清淡多吃一些滋阴润肺的百合,银耳,石斛不宜过食辛辣燥热,肥腻的食物最后说一下,今天的土木相合,土星、木星、地球连城一线。其实今年3月火星,木星与土星就有黎明时分相遇;10月初,又出现火星冲日;还有10月底,石家庄出现双日同天,11月初时,沈阳天空中出现“三个太阳”11月15日商洛又出现双日。。。庚子年还出现很多自然大事和预言澳大利亚森林大大火,新冠,东非蝗灾,南极出现历史高温,红色积雪,加州大火,9月拉尼娜现象。。。要不要担心那些可怕的预言?木是生命之机,木主仁义,代表观念,伦理;土主信,象征着法度,社会制度,权威木克土,加上庚子年,是会有变革之象子月,对应的本来就是地雷复卦木土变革,在一阳来复的时刻发生,这代表着变革中有净化的力量发生。什么是净化?好的留下,坏的去掉什么是好?什么是坏?老子早就把答案告诉我们了——执大象,天下往无论环境如何,无论经历什么黑暗,天道不改,正道不移与人为善,顺应天道得以善终与人为恶,倒行逆施,私欲者这必将自食恶果坚定这一点信念后正气存内,邪不可干,精神内守,病安从来。 -



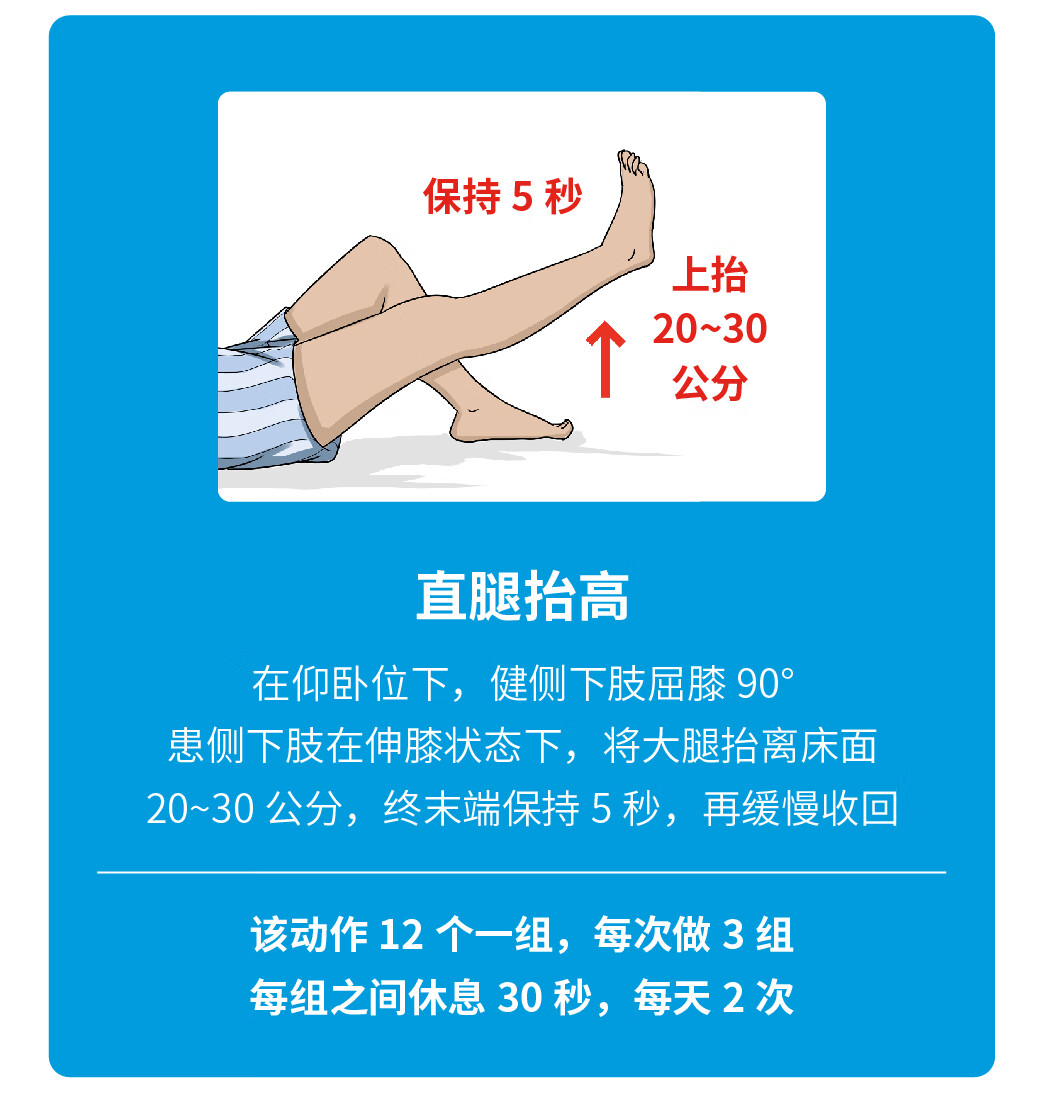
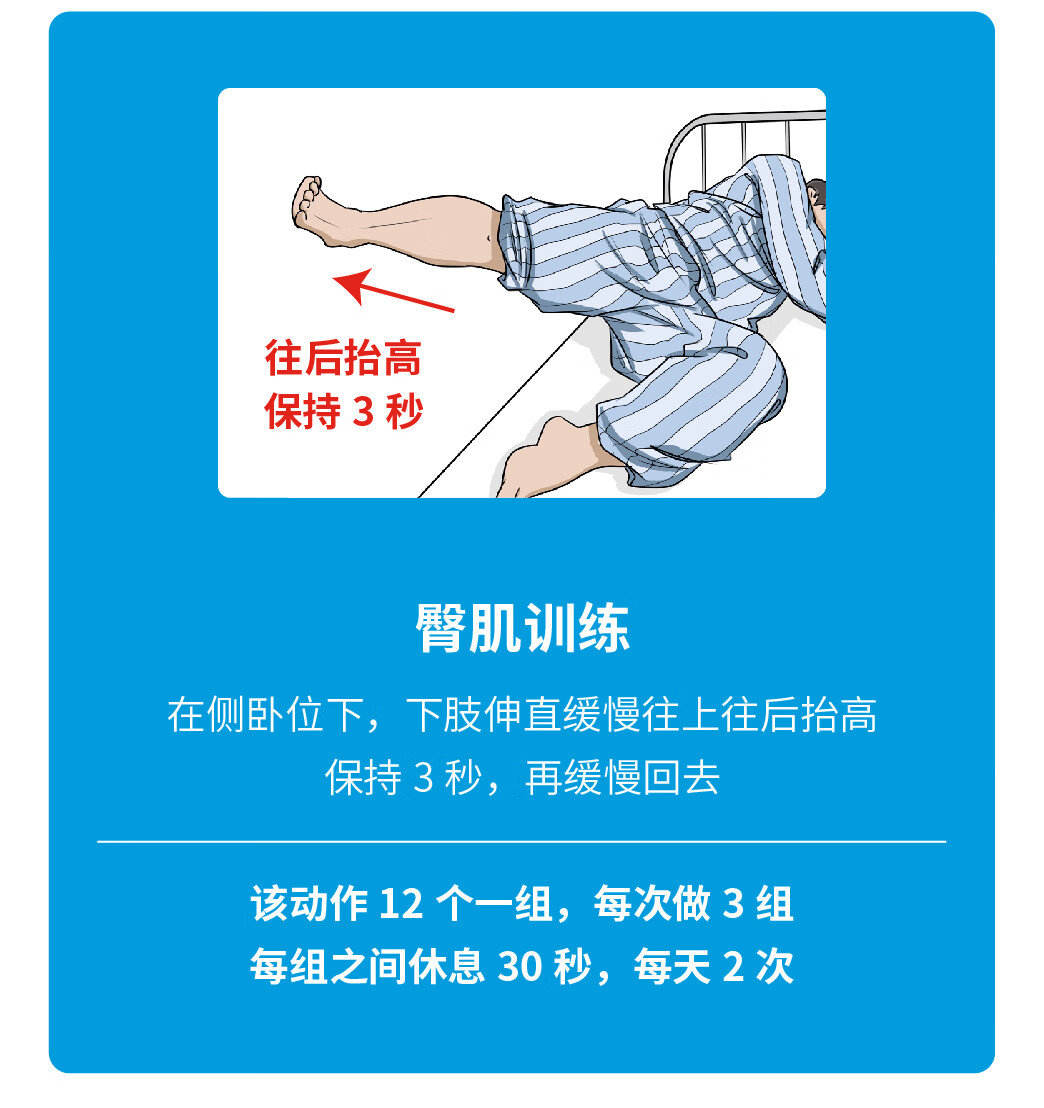
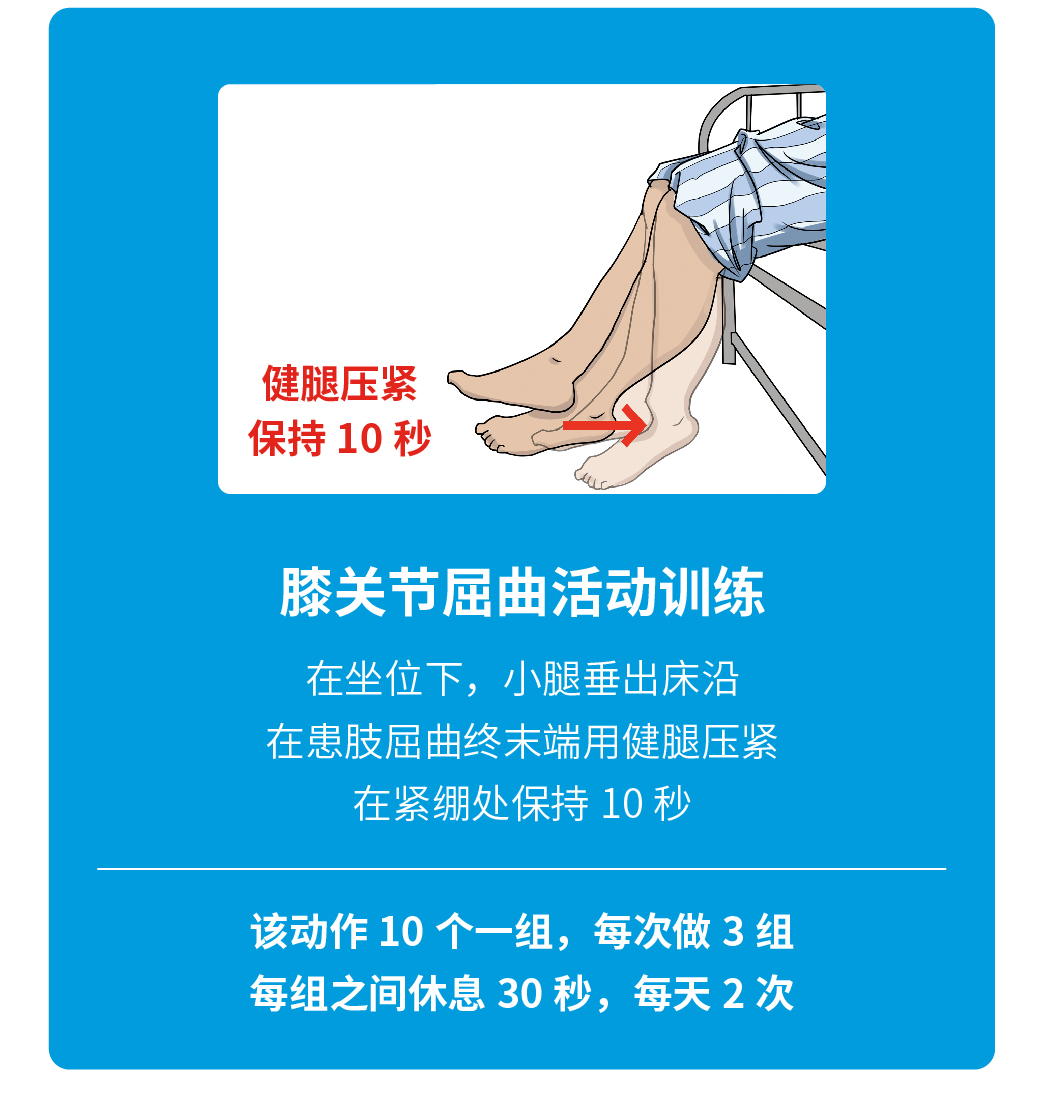

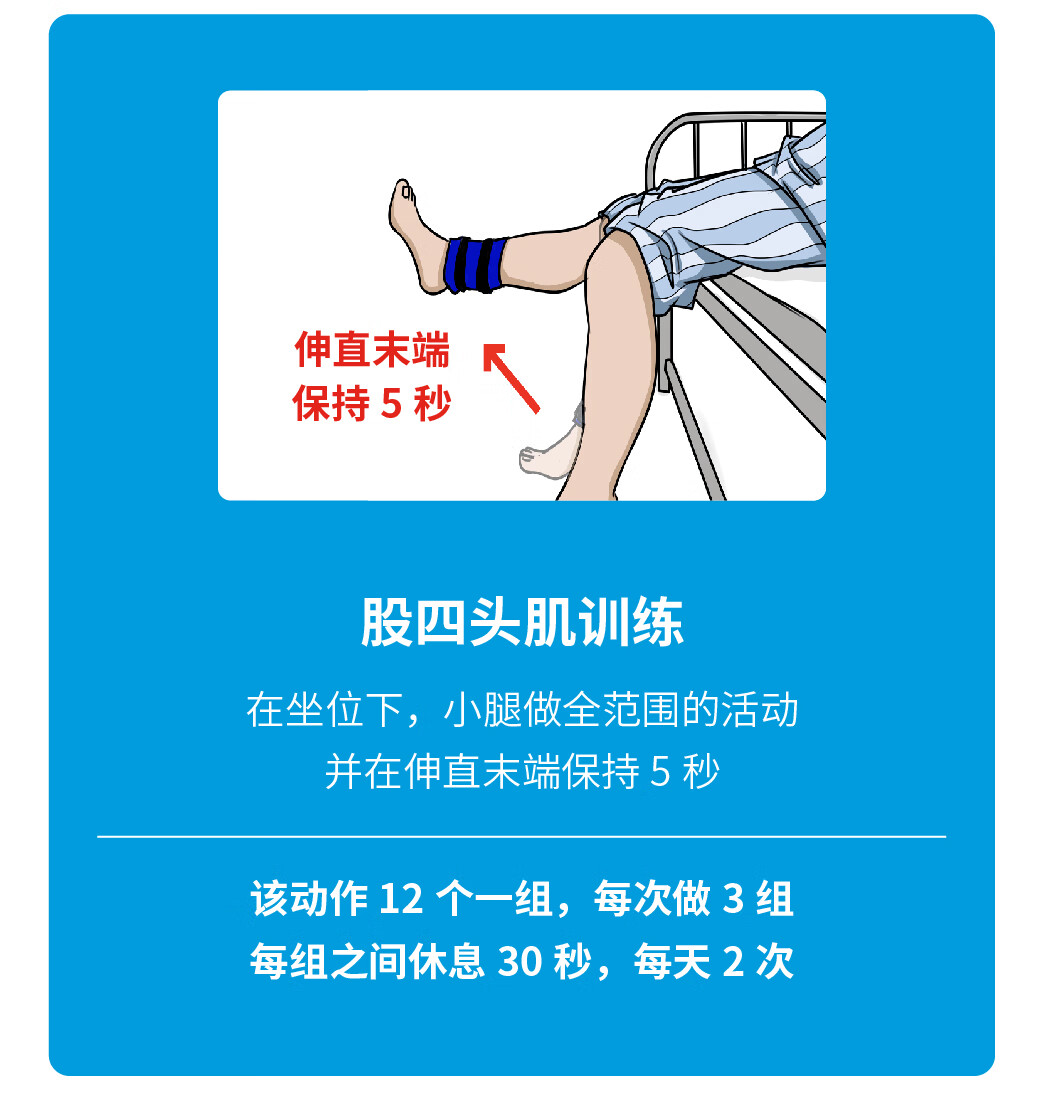



特别感谢
该科普文章医学专业性内容部分由上海交通大学医学院附属仁济医院 骨关节外科 岳冰(主任医师)提供/审核
-

妊娠期间急性肾损伤(AKI)是孕产妇以及胎儿发病和死亡的一个重要原因。AKI与慢性肾病(CKD)和终末期肾病(ESKD)、不良心血管事件的风险增加、住院时间更长相关。早期识别和治疗妊娠期AKI至关重要,是挽救生命的潜在措施。
由于产前诊疗的改善,发达国家妊娠相关AKI的发病率较低,但最近十年来,研究发现,美国的发病率几乎增加了3倍,可能是因为以下原因所致:孕妇年龄较大,合并症较多,AKI检出率较高,妊娠期高血压的发病率增加,肥胖率增加。相比之下,发展中国家近年来妊娠相关AKI总体上有所下降,但发病率仍然高于发达国家。在印度,住院女性中妊娠相关AKI从20世纪80年代的15%下降到21世纪初的1.5%。一项来自中国的研究显示,妊娠相关AKI的发病率下降了0.2%-1.8%。
妊娠期AKI的诊断
临床实践中,妊娠期AKI的诊断并未标准化,因为妊娠相关AKI的定义不一致。而且妊娠期肾小球超滤导致血清肌酐的生理性降低,会影响AKI的检测。 目前妊娠期AKI的诊断尚无明确的标准。应注意妊娠期血清肌酐水平的变化趋势,在特定的临床环境下,即使肌酐的微小变化也能敏感地反映早期肾损伤。例如,在新发高血压的女性患者中,伴随着血清肌酐增加0.3 mg/dL、肝酶增加以及血小板减少,就反映了AKI的可能,需要密切随访肾功能。对AKI的初步评估应包括,全面回顾患者的CKD、慢性高血压、糖尿病、先兆子痫、系统性红斑狼疮和肾小球疾病史。
妊娠剧吐和感染性流产是妊娠早期发生AKI的常见原因。大多数发生在妊娠中期和晚期的AKI,与先兆子痫、HELLP综合征(以溶血、肝酶升高和血小板减少为特点)、AFLP(急性妊娠脂肪肝)、TTP(血栓性血小板减少性紫癜)等血栓性微血管病和胎盘早剥等妊娠并发症有关。非典型溶血尿毒综合征 (aHUS)和非甾体抗炎药(NSAID)引起的肾损伤,是产后AKI的常见原因。
诊断评估应包括尿液分析、尿液显微镜检查、全面代谢检查、凝血检查、适当的血清学检查以及对用药史的全面检查。妊娠期血清补体水平升高是因为肝脏合成增加,这使得狼疮性肾炎的诊断变得复杂。 应当进行肾脏超声检查以排除梗阻性原因所致AKI,例如病理性肾积水。由于妊娠期高凝状态,如怀疑栓塞性疾病, 应行多普勒超声检查。妊娠中晚期AKI的常见原因,如先兆子痫、HELLP综合征、TTP、aHUS、AFLP和狼疮性肾炎,可能会有重叠表现,需要详细评估。
当实验室评估AKI无法下诊断时,可以考虑肾活检,因为明确诊断有助于采取合适的治疗,超过活检带来的风险。肾活检的决策要基于妊娠时期、可用的治疗方案和妊娠活力。妊娠晚期的活检有更高的并发症风险,尤其是妊娠25周后, 建议活检在妊娠早期和中期进行,最好避免在妊娠晚期进行活检,除非AKI治疗可显著改善母婴结局。
根据胎儿成熟度和肾功能下降对胎儿和母亲的影响,在可行的情况下,应 权衡提前分娩的可能性。对于妊娠晚期的孕妇来说,在活检前分娩可能是一个更为谨慎的选择,尤其是在胎儿已经达到存活能力的情况下。应与患者充分讨论并发症和风险,包括大出血需要输血、栓塞、严重产科并发症和胎儿死亡的风险。 AKI发生风险高的女性应在产后进行评估,定期监测血压、肾功能和蛋白尿情况,包括怀孕前患有CKD的女性和怀孕期间出现先兆子痫的女性。
妊娠期AKI的处理
妊娠期AKI的治疗应该由一个多学科团队来进行,由肾脏科医生、产科医生和新生儿医生组成。 治疗妊娠相关AKI的一般措施包括:确定肾损伤的原因,静脉液体复苏,必要时及时开始透析,必要时提前分娩。
静脉液体复苏对于肾前性AKI至关重要,但对于有先兆子痫的女性,因为有发生肺水肿的风险,因此应谨慎进行静脉液体复苏。肾损伤并发症的治疗方法与非妊娠患者相似,例如,对代谢性酸中毒使用补碱疗法,对容量超负荷使用袢利尿剂,对贫血患者输血,对高钾血症使用钾结合剂。
AKI的特异性治疗取决于肾损伤的根本原因。 肾小球肾炎的治疗包括类固醇和免疫抑制剂,当对孕妇使用时,应权衡风险和益处。抗代谢药物,如霉酚酸酯,由于其致畸性,在妊娠期间禁用。妊娠期间或可使用低剂量类固醇,但需监测妊娠期糖尿病的发生。 硫唑嘌呤和钙调神经磷酸酶抑制剂(环孢素和他克莫司)不是致畸药物,是妊娠期常用的免疫抑制药物。妊娠期间需要较高剂量的他克莫司和环孢素来达到治疗目标,因此应经常监测药谷浓度。
重度先兆子痫、HELLP综合征和AFLP的治疗,需要及时分娩。 如果在妊娠34周前分娩,则应给予糖皮质激素以降低新生儿呼吸窘迫综合征的风险。
血栓性微血管病(包括TTP)和非典型HUS的治疗,包括血浆置换和依库珠单抗(用于aHUS)。ADAMTS13缺乏性血栓性微血管病(TMA)的患者,治疗目标是通过血浆置换恢复酶活性,如果血浆置换失败, 利妥昔单抗是一种治疗选择。但妊娠相关TMA应谨慎使用利妥昔单抗,在不到10%的新生儿中观察到了胎儿毒性(血小板减少、嗜中性粒细胞减少和B细胞减少),短期获益还是存在的,目前还没有研究对利妥昔单抗在新生儿中的长期安全性进行评估。
总结
妊娠期AKI与孕产妇死亡率增加以及孕产妇和胎儿不良结局有关。在怀孕期间,应定期监测肾功能,特别是高危女性。妊娠期AKI的诊疗需要一个多学科团队来对孕妇进行管理,以改善产妇和胎儿结局。目前,妊娠期AKI仍然没有得到充分的认识,需要继续探索其长期影响。
参考文献:
Adv Chronic Kidney Dis. 2020;27(6):455-460.
京东健康互联网医院医学中心
作者:杨超,毕业于北京大学医学部,现在北京大学第一医院工作,研究方向为慢性肾脏病。
-

新生儿双侧永久性严重听力下降的患病率约为1.1例/1000新生儿;每1000名新生儿中可能还有1-2名发生双侧轻至中度听力下降或单侧听力下降。由于新生儿听力筛查策略的实施,目前听力下降检测出的年龄已大大降低。随着年龄的增长,儿童还会因多种病因失去听力,例如颞骨骨折、耳毒性药物、遗传性听力损失的延迟发作等,据估计,18岁以前儿童的听力下降患病率高达18%。早期识别儿童听力下降,进行早期干预,包括使用助听器和强化言语治疗,可带来更好的结局。
先天性听力下降
永久性先天感觉神经性和混合性听力下降的最常见原因是先天性巨细胞病毒感染,颞骨结构异常和遗传原因。先天性巨细胞病毒感染是导致听力下降的主要原因,也很常见。先天性感染,包括梅毒和风疹,也可能会导致听力下降。风疹曾经是先天性感觉神经性耳聋的最常见病毒原因,现在由于孕妇接种疫苗而变得罕见。
许多解剖异常也与遗传原因有关,包括腮-耳-肾综合征和CHARGE综合征。腮-耳-肾综合征是一种常染色体显性遗传性疾病,主要表现为听力下降、耳前瘘管、鳃裂发育异常、肾发育不良等。CHARGE综合征是一种罕见的常染色体显性遗传病,主要表现为:眼残缺、心脏病变、后鼻孔闭锁、生长发育障碍和/或中枢神经系统畸形、性腺发育不良、耳畸形和/或耳聋。
听力下降的发生率在早产儿中有所增加,并随胎龄和出生体重的增加而发生率下降。新生儿重症监护病房(NICU)中,1.2%至7.5%的婴儿会出现听力下降;出现以下情况时,NICU相关听力下降发生率会增加:高胆红素血症,败血症,新生儿细菌性脑膜炎,坏死性小肠结肠炎,长时间机械通气,耳毒性药物,使用体外膜肺氧合等。
迟发性听力下降
如果家长发现孩子的听力、说话或交流有些问题,需考虑到迟发性听力下降的可能性。如果存在围产期危险因素,例如先天性巨细胞病毒感染或体外膜肺氧合,也可能发生迟发性听力下降。超过119个基因与感觉神经性或混合性听力下降有关。其中,综合征占所有遗传原因的30%,常与迟发性或进行性听力下降有关,包括Pendred综合征,Usher综合征和Alport综合征。
Pendred综合征是遗传性感觉神经性听力下降的最常见综合征,与甲状腺功能不全、甲状腺肿、前庭导水管增大和Mondini内耳发育不全有关。 Usher综合征也是常染色体隐性遗传病,具有3种临床类型,可基于听力下降程度、前庭功能障碍和视力丧失发病年龄进行分型。 Alport综合征通常在儿童晚期发现,可出现肾功能衰竭、眼部异常和进行性感觉神经性听力减退。
一些非综合征性隐性基因也与进行性感觉神经性听力下降有关,这些儿童可能在新生儿听力筛查中表现正常,随着年龄增长而出现进行性耳聋。这些基因包括GJB2,MYO15A和STRC。进行性听力下降的常染色体显性基因包括TMC1和KCNQ4。
先天性感染后也可能发生迟发性听力下降。基于既往报道,产前暴露于弓形虫病、风疹、巨细胞病毒、疱疹病毒、梅毒等是先天性听力下降的常见原因。但是,这些微生物的流行病学已经改变,在许多国家,已剩下先天性巨细胞病毒感染是造成迟发性听力下降的主要原因。所有新生儿中先天性巨细胞病毒感染的患病率为0.4%至2.3%。在确诊为先天性听力下降的婴儿中,有6%至7%有先天性巨细胞病毒感染。但是,高达43%的先天性巨细胞病毒感染婴儿在新生儿听力筛查中正常,随后在婴儿期或儿童期出现感觉神经性听力下降。
前几年爆发了寨卡疫情,数据显示,先天性寨卡病毒感染可能导致听觉丧失。2019年对包含巴西、哥伦比亚和美国266名寨卡感染婴儿和儿童在内的10篇文章进行分析发现,听力下降发生率范围为6%至68%。还需要更多的研究来确定进行性听力下降的可能性,并更加明确听力下降的实际患病率。
获得性听力下降
出生后的获得性听力下降的原因包括创伤、感染、耳毒性药物使用或自身免疫性疾病。儿童听力下降中,大部分是由于获得性病因引起的。在导致儿童听力下降的可预防病因中,世界卫生组织将31%归因于感染,17%为产后并发症,4%为母婴使用耳毒性药物(如氨基糖苷类),8%为其他原因。
创伤可能导致传导性、混合性或感觉神经性听力下降,具体取决于颞骨损伤的部位和类型。鼓膜穿孔或听骨链损伤可导致传导性听力下降。颞骨骨折可损伤耳蜗、耳蜗神经或引起淋巴管瘘,这通常会导致严重的感觉神经性听力下降。颞骨震荡伤而没有骨折,也可能导致暂时性或永久性感觉神经性听力下降。
感觉神经性听力下降的感染原因包括麻疹、腮腺炎、水痘带状疱疹、莱姆病、细菌性脑膜炎等。与接种疫苗的儿童相比,未接种疫苗的儿童更容易患麻疹和腮腺炎并伴有听力下降。莱姆病可导致听力下降,但较罕见且可以治疗。听力下降常见病因为细菌性脑膜炎,可能是进行性的,最常见的是肺炎链球菌感染。
已知具有耳毒性并可能导致永久性听力损失的药物包括氨基糖苷类、抗肿瘤药(尤其是顺铂)、袢利尿剂;其他药物,例如水杨酸和大环内酯类药物(包括阿奇霉素),导致的听力损失通常是可逆的。密切监测药物剂量和血清水平可以减少内耳损伤的可能性。
自身免疫相关的听力下降原因包括局限于内耳的自身免疫功能障碍或系统性自身免疫疾病,例如Cogan综合征(间质性角膜炎、进行性听力损失和前庭功能障碍)。听力下降通常迅速进展,可能对免疫抑制剂有反应。
参考文献:
JAMA. 2020; 324(21):2195-2205.
京东健康互联网医院医学中心
作者:李延龙,北京协和医学院硕士,专业方向为慢性病的预防与控制。以第一作者或共同作者在国内外期刊发表论文10余篇。
-

随着过去10年免疫检查点抑制剂在临床上的成功,人们对癌症的免疫疗法产生了极大的兴趣。免疫检查点抑制剂的重要性不言而喻,2018年诺贝尔生理学或医学获奖就授予了研究CTLA-4的James Allison教授和研究PD-1的Tasuku Honjo教授。
免疫检查点抑制剂对黑色素瘤,非小细胞肺癌,头颈部鳞状细胞癌,肾细胞癌,霍奇金淋巴瘤,尿路上皮癌,胃癌,原发性纵隔B细胞淋巴瘤,默克尔细胞癌,肝细胞癌和宫颈癌都有效。然而,即使在免疫应答型的肿瘤中,大多数患者也没有持久的疾病缓解能力。对于许多肿瘤类型,免疫检查点抑制剂单药治疗无效。因此,可预测免疫疗法和联合疗法效果的生物学标志物引起了众多研究者的兴趣。
近日,著名医学期刊《Lancet》刊登了一篇综述,总结了免疫治疗与化疗、靶向治疗、放射治疗和其他免疫调节剂的联合治疗进展,分析了选择治疗方案和制定联合治疗策略的临床考虑。

图源:《Lancet》官网
联合化疗
化疗诱导癌细胞死亡可以促进肿瘤抗原释放和抗原递呈,并刺激免疫效应。肿瘤体积的减少不仅可以让免疫疗法有更多的时间发挥作用,还可以降低产生抗性克隆的可能性。在非小细胞肺癌、小细胞肺癌和三阴性乳腺癌中,免疫检查点抑制剂+标准化疗已取得了成功。然而,在三阴性乳腺癌中,仅在肿瘤浸润免疫细胞具有PD-L1表达的患者中, 阿特珠单抗显示出了增强白蛋白结合型紫杉醇的抗肿瘤疗效。
免疫治疗与抗体药物偶联物(ADC)的联合也在探索中。在HER2阳性和雌激素受体阳性的乳腺癌患者中,以HER2为靶点的ADC药物T-DM1与分散在肿瘤间质中的肿瘤浸润淋巴细胞显著增加有关。在原位HER2阳性模型中,T细胞耗竭降低了T-DM1治疗小鼠的总体存活率,提示免疫应答对T-DM1的疗效至关重要。基于这些数据,一些针对ADC的研究正在探索与免疫治疗相结合的用药策略。
联合靶向治疗
在过去的5年里,抗PD-1或抗PD-L1抗体治疗+靶向治疗已被广泛研究。一个基本目标是,联合用药应该比连续给药更有效,但要注意联合用药通常比单一疗法会产生更多的副作用。
两个显著的成功案例是抗PD-1药物派姆单抗+阿西替尼(血管内皮生长因子[VEGF]受体酪氨酸激酶抑制剂)以及阿西替尼+抗PD-L1药物阿维鲁单抗用于晚期肾细胞癌的治疗。 两种联合用药都比单一使用标准治疗药物舒尼替尼更有效,因此,这两种联合用药策略都被监管机构所批准。
联合放疗
目前有超过100项试验正在检查放疗联合免疫治疗或放射免疫偶联物的疗效。放疗可以通过肿瘤抗原的释放、I型干扰素感应、和改良的免疫抑制肿瘤微环境来促进免疫,形成对非辐照损伤的远位效应,这是放射免疫治疗的基本原理。有一些早期的研究表明,放疗和CTLA-4抑制剂在化疗难治性非小细胞肺癌中,可诱导全身抗肿瘤T细胞,放疗后血清干扰素β升高和T细胞克隆的早期变化是最有力的应答预测因子。
PEMBRO-RT的II期随机试验显示,仅使用免疫检查点抑制剂12周的应答率为18%,而立体定向放疗后再使用免疫检查点抑制剂12周应答率为36%。尽管该研究未达到预定的疗效终点,但在PD-L1阴性亚组中观察到无进展生存期和总体生存期的获益,这表明立体定向放射疗法可有效治疗冷肿瘤。然而,最佳放疗策略尚未确定。有初步研究表明,低剂量放疗可能是另一种增强检查点抑制剂应答的策略。
与其他免疫调节剂联用
抗PD-1抗体和CTLA-4抑制剂联合使用增加了黑色素瘤、肾细胞癌和高度微卫星不稳定(MSI)结直肠癌的持久应答。在一项III期临床试验中,与伊匹单抗(19%)或纳武单抗(44%)单药治疗相比,纳武单抗+伊匹单抗联合治疗的晚期黑色素瘤患者,有更高的应答率(57%)。这一结果推动了这种用药组合对其他更多类型肿瘤的研究。
PD-1/PD-L1与其他药物的联用也在积极研究中,如LAG3抑制剂,TIM-3抑制剂,T细胞活化V结构域Ig抑制剂和TIGIT。在一项II期试验中,有报道称在阿特珠单抗的基础上加用TIGIT抗体替瑞利尤单抗可以增强PD-L1阳性的非小细胞肺癌患者的疗效,但其效果仅限于高PD-L1(肿瘤比例评分[TPS]≥50%)的患者。
联合治疗的副作用
联合用药可能提高疗效,但也可能增强毒性。例如,在CheckMate 067试验中,对晚期黑色素瘤患者进行了研究,结果显示59%接受纳武单抗+伊匹单抗的患者、23%接受纳武单的患者和28%接受伊匹单抗的患者报告了与治疗相关的3-4级不良事件。因此,在决定是采用单一治疗还是联合治疗时,应考虑相关毒性。
在设计新的联合疗法时,毒性是一个重要的问题。不是所有已批准药物都可以安全地与免疫治疗联合。例如,维罗非尼不能与伊匹单抗联合使用,因为有报道称维罗非尼会产生肝毒性效应。维罗非尼+考比替尼+阿特珠单抗的联合使用导致了较多但可控的毒性。在IMspire150试验中,治疗相关的3级或4级不良事件发生率在阿特珠单抗+维罗非尼+考比替尼的患者中为79%(182/230),在安慰剂+维罗非尼+考比替尼的对照组患者中为73%(205/281)。然而,目前尚不清楚联合用药的疗效是否优于依次用药,以及疗效的更优是否意味着毒性的增加。
其他临床考虑
一个重要的问题是,是否应在治疗早期采用联合疗法。在对免疫检查点抑制剂有反应的患者中,大多数试验在单药治疗失败后再开始联合用药,这种方法有三个主要缺点。首先,联合疗法可能对未做免疫治疗的患者有疗效,但不能增强免疫治疗耐药患者的疗效。第二,随着治疗线的增加,免疫治疗的疗效会降低。最后,一些患者可能存在不可逆转的耐药机制(如抗原递呈丧失)。另一种方法是从一开始就开始联合治疗。然而,这种方法将使对单一疗法就有反应的患者暴露在不必要的毒性环境中。需要进行详细的研究来确定联合治疗的时机(例如,疾病开始时vs进展时,或在长期稳定后),以及每种疗法对哪些患者有获益。
参考文献:
Lancet. 2020 Dec 4;S0140-6736(20)32598-8.
京东互联网医院医学中心
作者:梁辰,约翰霍普金斯大学公共卫生学院流行病学硕士,主要研究方向为慢性病流行病学。
-

门诊是遇到不懂的病人需要多交代几句#门诊 #医学常识
展开更多




















