简称:
-
*淑兰回复质量:非常满意服务态度:非常满意回复速度:非常满意functions/format.html图文问诊
-
*勇回复质量:非常满意服务态度:非常满意回复速度:非常满意functions/format.html图文问诊
-
*皓天回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*艳梅回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*全河回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*燕回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*桂佳回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*寿江回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*春华回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*文良回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
展开更多
-

肠内营养的选择是根据患者的病情和需求来决定的。首先,医生会进行全面评估患者的营养状态和消化吸收功能,确定是否需要肠内营养支持。
其次,医生会根据患者的病情、手术类型、胃肠道功能和预期治疗时长等因素,制定个性化的肠内营养方案,包括配方成分、摄入途径和用药管理。在选择肠内营养时,患者和家属也需要积极参与,与医生充分沟通,了解治疗方案的具体内容,做好治疗的准备和配合。
-

若您在当前成员用户下上传错了数据,可删除当前数据后切换到对应的成员内重新上传~ 若您在病历本内的数据上传错误,即可在对应的病历卡片上,点击【移动】,选择对应的成员进行数据转移~
-

近日,美国糖尿病协会(ADA)发布了2021版《糖尿病诊疗标准指南》,新指南中关于儿童糖尿病的流行病学、病理生理学以及治疗与成人糖尿病不同,为此,指南特别发布了针对儿童和青少年糖尿病的标准诊疗推荐。
营养治疗
建议儿童和青少年1型糖尿病患者进行个性化的营养治疗。
监测碳水化合物摄入是实现最佳血糖控制的一项关键。
由经验丰富的注册营养师开展全面的营养教育,每年更新一次,建议营养师评估与体重状况和心血管疾病风险因素有关的热量和营养摄入,并告知患者应该选择哪些营养素。
运动
推荐所有儿童和青少年1型糖尿病患者进行运动,每天进行60分钟中到高强度的有氧运动,每周至少进行3天高强度肌肉强化和骨骼强化活动。
确保患者运动前的血糖水平为90-250 mg/dL(5.0-13.9mmol/L),运动前、运动中、运动后可补充碳水化合物,根据计划的活动类型或强度进行个性化锻炼。
应教育患者在运动期间和运动后预防低血糖的策略,包括运动前减少餐时胰岛素剂量,减少基础胰岛素剂量,增加碳水化合物摄入,使用持续血糖监测等。
运动前、运动中、运动后的频繁血糖监测对于预防、检测和治疗运动期间低血糖和高血糖很重要。
血糖控制
儿童和青少年1型糖尿病患者应尽可能接受强化胰岛素治疗方案,即每日多次注射或持续皮下注射胰岛素。
所有儿童和青少年1型糖尿病患者每天应该多次自我监控血糖水平(每天6-10次),包括进食前,入睡前,以及一些特殊情况下,如锻炼、驾驶、出现低血糖症状等。
实时连续血糖监测+胰岛素治疗是降低和维持糖化血红蛋白水平或缓解低血糖的有效策略。
某些情况下,间歇性扫描式持续血糖监测+胰岛素治疗可以有效地取代自我血糖监测。
自动化胰岛素输送系统可被考虑用于改善血糖控制。
糖化血红蛋白目标必须个性化,并随着时间的推移进行重新评估。对于许多儿童来说,糖化血红蛋白水平<7%是合适的。
较不严格的糖化血红蛋白目标(如<7.5%)可能适合:不能明确表达出低血糖症状的患者;未察觉到的低血糖;无法获取胰岛素类似物、先进的胰岛素给药技术或连续血糖监测;不能定期检查血糖。
较不严格的糖化血红蛋白目标(<如8%)可能适用于有严重低血糖史、预期寿命有限或治疗弊大于利的患者。
如果进一步降低目标时,患者没有严重的低血糖,未对健康造成负面影响或增加诊疗负担,可以合理地为个别患者建议更严格的A1C目标(例如,<6.5%)。
建议将最近14天内的连续葡萄糖监测指标(血糖变化幅度较大的患者应更长时间),尽可能与糖化血红蛋白结合使用。
筛查和诊断
对于超重或肥胖且有一个或多个糖尿病危险因素的儿童和青少年中,应考虑在青春期开始或10岁时(以较早者为准),对糖尿病前期或2型糖尿病进行筛查。
如果检测结果正常,则应至少每3年进行一次重复检查,如果BMI增加,则检查频率增加。
空腹血糖、75g口服糖耐量试验2小时血糖和糖化血红蛋白可用于检测儿童和青少年的糖尿病前期或糖尿病。
儿童糖尿病管理
生活方式因素
应向超重/肥胖的2型糖尿病儿童青少年及家属提供综合生活方式干预计划,并与糖尿病治疗相结合,以实现减重7-10%的目标。
与所有儿童和青少年一样,应鼓励有糖尿病前期和2型糖尿病的儿童青少年每天至少参加60分钟的中到高强度的体育活动(每周至少3天肌肉和骨骼力量训练),并减少久坐行为。
与所有儿童一样,有糖尿病前期和2型糖尿病的儿童青少年的饮食应侧重于健康饮食模式,减少摄入高热量、缺乏营养的食品,特别是含糖饮料。
血糖目标
家庭血糖监测方案应个体化,并考虑到患者的药物治疗情况。
每3个月评估一次血糖状况。
对于大多数儿童和青少年2型糖尿病患者来说,仅口服药物治疗的情况下,合理A1C目标为<7%。更严格的A1C目标(如<6.5%)可能适合个别患者,例如进一步降糖没有出现显著低血糖或其他治疗不良反应。
如果低血糖风险增加,可能需要制定较不严格的A1C目标(如7.5%)。
药物治疗
诊断为2型糖尿病后,除了进行营养干预和体育活动等行为外,还应进行药物治疗。
偶然发现糖尿病或代谢稳定的患者(糖化血红蛋白<8.5%,无症状),如果肾功能正常,二甲双胍是首选的初始治疗药物。
有明显的高血糖血症(血糖≥250 mg/dL [13.9 mmol/L],糖化血红蛋白≥8.5%),诊断时无酸中毒,且有多尿、多饮、夜尿或体重减轻症状的青少年,应在开始使用二甲双胍时,先用基础胰岛素治疗。
对于酮症酸中毒患者,应开始皮下或静脉注射胰岛素治疗,以迅速纠正高血糖和代谢紊乱。一旦酸中毒缓解,可开始使用二甲双胍,同时继续皮下胰岛素治疗。
对于出现严重高血糖(血糖≥600 mg/dL [33.3 mmol/L])的患者,考虑评估高血糖高渗非酮症综合征。
如果没有甲状腺髓样癌病史或2型多发性内分泌肿瘤家族史的10岁或以上儿童,用二甲双胍(加或不加基础胰岛素)不能达到血糖目标时,则应考虑使用利拉鲁肽(GLP-1受体激动剂)。
接受基础胰岛素治疗但未达到血糖目标的患者,应改为每日多次注射基础胰岛素和餐前大剂量胰岛素。
初始使用胰岛素和二甲双胍的患者,根据家庭血糖监测结果达到血糖目标,超过2-6周的时间内,可以每隔几天减少10-30%的胰岛素剂量。
不建议使用未经FDA批准的药物治疗儿童青少年2型糖尿病患者。
手术
对于严重肥胖(BMI>35 kg/m2)、生活方式干预和药物干预后仍无法控制血糖和/或有严重合并症的2型糖尿病青少年,可以考虑进行代谢手术治疗。
参考文献:
Diabetes Care. 2021 Jan; 44(Suppl 1):S180-S199.
京东健康互联网医院医学中心
作者:肖靖,2009-2012年就读于301医院内分泌学硕士,2012年毕业后工作于北京博爱医院内分泌科。
-

经常有患者在门诊问我,自从生完孩子以后,腰一直都很痛,在我剖腹产的时候,麻醉医师在我腰部打了一针,是不是麻醉医师把我的腰给打坏了?
在这里,我可以很负责人的告诉大家,产后腰痛跟麻醉医生打麻醉一点关系都没有!
生孩子时打的麻醉叫“腰麻”,专业术语叫“硬膜外麻醉”,一般是在两个腰椎棘突间的韧带打一针,穿到腰部神经表面,再打入麻醉药!因为穿刺针非常的细,不会对我们的腰椎结构产生破坏,因此“腰麻”不是产后腰痛的罪魁祸首!那生完孩子后为什么会出现腰痛?原因比较多,我分析主要是以下3点:
1、10月怀胎,腰部承受更大的应力,导致腰骶部肌肉持续紧张,会产生腰肌劳损,这一点大家都能想得到!
2、此外,在怀孕期间,孕妇体内的雌激素、孕激素水平会发生变化,它们的变化会使全身韧带处于松弛状态,尤其是骨盆韧带的松弛,有利于分娩。但是它们也会导致腰部韧带(尤其是防止腰椎间盘突出的后纵韧带)松弛,使腰椎间盘容易突出,从而出现产后腰痛。
3、在生完孩子后,产妇喂奶姿势的不正确、抱孩子反复弯腰也会导致腰痛的加重。
那么如何解决产后腰痛呢?患者可以产后适当锻炼腰背部肌肉,保持喂奶姿势的正确(可参考我在好大夫写的文章:颈部及腰背肌锻炼(小燕飞和五点支撑)。
如果疼痛还是不缓解,而且没有母乳喂养,可以考虑吃点消炎止痛药,如果还在母乳喂养,尽量不要吃药,可以去正规的中医推拿科、康复理疗科做一些物理治疗等。

-

新生儿双侧永久性严重听力下降的患病率约为1.1例/1000新生儿;每1000名新生儿中可能还有1-2名发生双侧轻至中度听力下降或单侧听力下降。由于新生儿听力筛查策略的实施,目前听力下降检测出的年龄已大大降低。随着年龄的增长,儿童还会因多种病因失去听力,例如颞骨骨折、耳毒性药物、遗传性听力损失的延迟发作等,据估计,18岁以前儿童的听力下降患病率高达18%。早期识别儿童听力下降,进行早期干预,包括使用助听器和强化言语治疗,可带来更好的结局。
先天性听力下降
永久性先天感觉神经性和混合性听力下降的最常见原因是先天性巨细胞病毒感染,颞骨结构异常和遗传原因。先天性巨细胞病毒感染是导致听力下降的主要原因,也很常见。先天性感染,包括梅毒和风疹,也可能会导致听力下降。风疹曾经是先天性感觉神经性耳聋的最常见病毒原因,现在由于孕妇接种疫苗而变得罕见。
许多解剖异常也与遗传原因有关,包括腮-耳-肾综合征和CHARGE综合征。腮-耳-肾综合征是一种常染色体显性遗传性疾病,主要表现为听力下降、耳前瘘管、鳃裂发育异常、肾发育不良等。CHARGE综合征是一种罕见的常染色体显性遗传病,主要表现为:眼残缺、心脏病变、后鼻孔闭锁、生长发育障碍和/或中枢神经系统畸形、性腺发育不良、耳畸形和/或耳聋。
听力下降的发生率在早产儿中有所增加,并随胎龄和出生体重的增加而发生率下降。新生儿重症监护病房(NICU)中,1.2%至7.5%的婴儿会出现听力下降;出现以下情况时,NICU相关听力下降发生率会增加:高胆红素血症,败血症,新生儿细菌性脑膜炎,坏死性小肠结肠炎,长时间机械通气,耳毒性药物,使用体外膜肺氧合等。
迟发性听力下降
如果家长发现孩子的听力、说话或交流有些问题,需考虑到迟发性听力下降的可能性。如果存在围产期危险因素,例如先天性巨细胞病毒感染或体外膜肺氧合,也可能发生迟发性听力下降。超过119个基因与感觉神经性或混合性听力下降有关。其中,综合征占所有遗传原因的30%,常与迟发性或进行性听力下降有关,包括Pendred综合征,Usher综合征和Alport综合征。
Pendred综合征是遗传性感觉神经性听力下降的最常见综合征,与甲状腺功能不全、甲状腺肿、前庭导水管增大和Mondini内耳发育不全有关。 Usher综合征也是常染色体隐性遗传病,具有3种临床类型,可基于听力下降程度、前庭功能障碍和视力丧失发病年龄进行分型。 Alport综合征通常在儿童晚期发现,可出现肾功能衰竭、眼部异常和进行性感觉神经性听力减退。
一些非综合征性隐性基因也与进行性感觉神经性听力下降有关,这些儿童可能在新生儿听力筛查中表现正常,随着年龄增长而出现进行性耳聋。这些基因包括GJB2,MYO15A和STRC。进行性听力下降的常染色体显性基因包括TMC1和KCNQ4。
先天性感染后也可能发生迟发性听力下降。基于既往报道,产前暴露于弓形虫病、风疹、巨细胞病毒、疱疹病毒、梅毒等是先天性听力下降的常见原因。但是,这些微生物的流行病学已经改变,在许多国家,已剩下先天性巨细胞病毒感染是造成迟发性听力下降的主要原因。所有新生儿中先天性巨细胞病毒感染的患病率为0.4%至2.3%。在确诊为先天性听力下降的婴儿中,有6%至7%有先天性巨细胞病毒感染。但是,高达43%的先天性巨细胞病毒感染婴儿在新生儿听力筛查中正常,随后在婴儿期或儿童期出现感觉神经性听力下降。
前几年爆发了寨卡疫情,数据显示,先天性寨卡病毒感染可能导致听觉丧失。2019年对包含巴西、哥伦比亚和美国266名寨卡感染婴儿和儿童在内的10篇文章进行分析发现,听力下降发生率范围为6%至68%。还需要更多的研究来确定进行性听力下降的可能性,并更加明确听力下降的实际患病率。
获得性听力下降
出生后的获得性听力下降的原因包括创伤、感染、耳毒性药物使用或自身免疫性疾病。儿童听力下降中,大部分是由于获得性病因引起的。在导致儿童听力下降的可预防病因中,世界卫生组织将31%归因于感染,17%为产后并发症,4%为母婴使用耳毒性药物(如氨基糖苷类),8%为其他原因。
创伤可能导致传导性、混合性或感觉神经性听力下降,具体取决于颞骨损伤的部位和类型。鼓膜穿孔或听骨链损伤可导致传导性听力下降。颞骨骨折可损伤耳蜗、耳蜗神经或引起淋巴管瘘,这通常会导致严重的感觉神经性听力下降。颞骨震荡伤而没有骨折,也可能导致暂时性或永久性感觉神经性听力下降。
感觉神经性听力下降的感染原因包括麻疹、腮腺炎、水痘带状疱疹、莱姆病、细菌性脑膜炎等。与接种疫苗的儿童相比,未接种疫苗的儿童更容易患麻疹和腮腺炎并伴有听力下降。莱姆病可导致听力下降,但较罕见且可以治疗。听力下降常见病因为细菌性脑膜炎,可能是进行性的,最常见的是肺炎链球菌感染。
已知具有耳毒性并可能导致永久性听力损失的药物包括氨基糖苷类、抗肿瘤药(尤其是顺铂)、袢利尿剂;其他药物,例如水杨酸和大环内酯类药物(包括阿奇霉素),导致的听力损失通常是可逆的。密切监测药物剂量和血清水平可以减少内耳损伤的可能性。
自身免疫相关的听力下降原因包括局限于内耳的自身免疫功能障碍或系统性自身免疫疾病,例如Cogan综合征(间质性角膜炎、进行性听力损失和前庭功能障碍)。听力下降通常迅速进展,可能对免疫抑制剂有反应。
参考文献:
JAMA. 2020; 324(21):2195-2205.
京东健康互联网医院医学中心
作者:李延龙,北京协和医学院硕士,专业方向为慢性病的预防与控制。以第一作者或共同作者在国内外期刊发表论文10余篇。
-
 气胸在临床上是比较多见的,一般是属于内科疾病,但是由于创伤导致的气胸可以就诊于胸外科积极治疗。常见的症状有呼吸困难,胸闷,可伴有咳嗽,冷汗,心律失常,意识不清等。在临床上,创伤性气胸是比较多见的,一般是由于肋骨骨折或者异物刺穿胸膜腔而导致的。对于临床上出现创伤性气胸,首先需要判断气胸的分类,一般可以分为单纯性气胸,开放性气胸,高压性气胸。对于单纯性气胸,需要根据气体的量来选择治疗方式,对于小量的气胸可以保守治疗,嘱其严格卧床休息,给予止痛、镇静等对症治疗,同时治疗外部创伤。对于气体量较大的,可以选择进行胸腔穿刺抽气或者胸腔闭式引流来减轻患者的临床症状。如果患者属于开放性气胸或者高压性气胸,首先需要将开放性气胸的创口封闭,然后再给予胸腔闭式引流等对症治疗来控制患者气胸的发展。对于由于支气管创伤引起的,可以采用支气管微球或者栓子堵塞支气管来改善气胸的症状。还有一部分患者虽然经过内科的积极治疗,但是气胸的症状并没有得到缓解,可以选择进行外科手术治疗,特别是适用于双侧气胸或者张力性气胸有多发多处骨折的患者。总之,临床上对于出现创伤性气胸,首先要明确气胸的类型,然后再根据患者的临床症状来选择合适的治疗方式,尽早的控制病情的发展。
气胸在临床上是比较多见的,一般是属于内科疾病,但是由于创伤导致的气胸可以就诊于胸外科积极治疗。常见的症状有呼吸困难,胸闷,可伴有咳嗽,冷汗,心律失常,意识不清等。在临床上,创伤性气胸是比较多见的,一般是由于肋骨骨折或者异物刺穿胸膜腔而导致的。对于临床上出现创伤性气胸,首先需要判断气胸的分类,一般可以分为单纯性气胸,开放性气胸,高压性气胸。对于单纯性气胸,需要根据气体的量来选择治疗方式,对于小量的气胸可以保守治疗,嘱其严格卧床休息,给予止痛、镇静等对症治疗,同时治疗外部创伤。对于气体量较大的,可以选择进行胸腔穿刺抽气或者胸腔闭式引流来减轻患者的临床症状。如果患者属于开放性气胸或者高压性气胸,首先需要将开放性气胸的创口封闭,然后再给予胸腔闭式引流等对症治疗来控制患者气胸的发展。对于由于支气管创伤引起的,可以采用支气管微球或者栓子堵塞支气管来改善气胸的症状。还有一部分患者虽然经过内科的积极治疗,但是气胸的症状并没有得到缓解,可以选择进行外科手术治疗,特别是适用于双侧气胸或者张力性气胸有多发多处骨折的患者。总之,临床上对于出现创伤性气胸,首先要明确气胸的类型,然后再根据患者的临床症状来选择合适的治疗方式,尽早的控制病情的发展。 -

根据世界卫生组织报告,2018年有210万例新发肺癌病例,其中土耳其、日本、中国、美国和英国的发病率最高。肺癌是一组异质性肿瘤,分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)。包括50多种不同的组织学亚型,例如,NSCLC又分为腺癌、鳞状细胞癌和大细胞癌。
近年来,肺癌治疗取得了相当大的进展,最初仅限于细胞毒化疗。化疗药物阻断细胞周期,攻击快速分裂的细胞。这种传统的治疗方法特异性较低,既会攻击正常细胞,也会攻击癌细胞,导致显著的副作用。癌症治疗的最新进展包括靶向治疗,这种药物可以阻断仅在肿瘤细胞中过度表达或过度活跃的特定分子。靶向治疗大致有三种类型:单克隆抗体、小分子抑制剂和免疫毒素。
肺癌治疗的突破主要体现在患者5年生存率的提高上,从20世纪70年代早期的10.7%上升至21世纪10年代的19.8%。然而,仍然存在一些挑战,如发现新的驱动基因改变,了解耐药机制,发现新疗法的疗效预测因子。NSCLC约占所有肺癌病例的85%,近年来晚期肺癌的治疗经历了从细胞毒性治疗到靶向治疗的转变,下文将重点关注NSCLC的治疗新靶点。
抗EGFR药物
表皮生长因子受体(EGFR)基因是NSCLC的主要驱动基因之一。2016年的一项荟萃分析发现,约32.3%的NSCLC肿瘤存在EGFR基因突变。这种突变在女性中(比男性高19.7%)、亚洲人(比北美人群高52%)、非吸烟者(比过去或者当前吸烟者高27.8%)和腺癌患者中(比其他组织类型高26.3%)更为常见。
抗EGFR治疗包括酪氨酸激酶抑制剂(TKI),是结合EGFR受体的靶向药物。第一代药物以可逆的方式与EGFR的ATP位点结合并抑制磷酸化,阻断EGFR相关的信号通路。第二代TKI通过引起EGFR的催化结构域的共价修饰,不可逆地阻断了该蛋白的酪氨酸激酶活性。第一代TKI包括厄洛替尼、吉非替尼和埃克替尼;第二代TKI包括阿法替尼和达克替尼。各种III期临床试验均显示出,晚期NSCLC中第一代和第二代TKI相比铂类化疗的益处。
第一代和第二代TKI的疗效取决于EGFR所携带的突变。大约70%的EGFR突变肿瘤对TKI有临床反应;剩下的30%对TKI药物一开始就耐药(称为原发耐药),对TKI治疗没有反应,与EGFR外显子20复制或其他突变有关,如PTEN和PIK3CA。尽管有良好的结果,第一代和第二代TKI有相当大的毒性。这些药物可能引起诸如口腔炎、腹泻、皮疹和甲沟炎等副作用,约40%的人群需要降低剂量。
靶向T790M的药物
为克服T790M导致的耐药,奥西替尼、美雷替尼和rociletinib等第三代TKI药物应运而生。这些药物不可逆地与T790M突变的EGFR蛋白高效结合,有效抑制癌症生长,第三代TKI的毒副作用更少。III期AURA研究发现,与NSCLC的标准化疗相比,奥西替尼的PFS增加了5.7个月,疾病控制率(DCR)增加了19%。FLAVUR 的 III期研究比较了奥西替尼和第一代TKI,发现PFS有所增加,从10.2个月延长到18.9个月。
ALK抑制剂
在NSCLC患者中,间变性淋巴瘤激酶(ALK)基因突变也是是药物治疗的常见靶点,约有5%的患者存在这种突变。克唑替尼是一种ALK抑制剂,在一项开放标签的3期临床试验中,针对ALK阳性晚期NSCLC的一线治疗,对克唑替尼与标准化疗的疗效进行了比较。结果显示,与化疗组相比,克唑替尼组的PFS明显更长(10.9个月vs. 7.0个月),然而,中位总生存期却没有显示出显著优势。克唑替尼组有恶心、疲劳、呕吐、食欲减退等不良反应。III期PROFILE 1014试验,也比较了克唑替尼与化疗作为ALK阳性NSCLC患者的一线治疗方案的疗效。克唑替尼每天两次,每次250mg;化疗组给予培美曲塞500 mg/m2 +顺铂75/m2或卡铂静脉注射,每3周一次,最多6个周期。结果显示,克唑替尼组的中位总生存期尚未达到,而常规化疗组的中位总生存期为47.5个月。
阿来替尼是一种高选择性ALK抑制剂。在一项随机、开放标签的3期临床试验中,研究者比较了阿来替尼(600mg,每日2次)和克唑替尼(250mg,每日2次)对ALK阳性NSCLC患者的疗效。结果显示阿来替尼组的PFS率较高(68.4% vs. 48.7%)。与克唑替尼相比,阿来替尼组的3级或5级不良事件更少(41% vs 50%)。
一项随机III期试验招募了303名以前未接受过化疗的患者,接受阿来替尼(600mg,每日两次)或克唑替尼(250mg,每日两次)治疗。在中位随访17.6个月(克唑替尼)和18.6个月(阿来替尼)期间,阿来替尼组和克唑替尼组疾病进展发生率分别为41%和68%。在阿来替尼组中有82.9%的患者有缓解,克唑替尼为75.5%。阿来替尼组3 - 5级不良事件发生率较低(41 vs 50%)。
c-MET抑制剂
c-MET蛋白是NSCLC进展的另一个关键因素,使其成为新的希望靶点。靶向c-MET激活机制的药物是治疗NSCLC的重要手段,这些药物包括MET酪氨酸激酶活性抑制剂(克唑替尼,特泊替尼,卡马替尼),针对MET(奥那妥组单抗)或HGF (利妥木单抗)的单克隆抗体。
AcSe II期试验发现,克唑替尼用于MET突变患者的ORR为36%,MET扩增患者的ORR为32%。METROS II期试验发现,接受克唑替尼治疗的MET突变或扩增患者的中位ORR为27%,PFS为4.4个月。
对卡马替尼的试验显示了更有希望的结果。卡马替尼主要靶向扩增和第14外显子突变的MET。GEOMETRY Mono-1试验研究了卡马替尼在晚期NSCLC中的疗效,结果显示ORR为71.4%,缓解持续时间为8.41个月。该研究还发现,与之前治疗的患者相比,既往未治疗过的患者PFS高了近4个月。
在对MET扩增和EGFR突变患者进行分析的II期JO28638试验中,与厄洛替尼相比,奥那妥珠单抗的ORR为68.9%,PFS为8.5个月。另一项对奥那妥珠单抗+贝伐珠单抗+培美曲塞进行的研究发现,加用奥那妥珠单抗并不能带来益处,只会增加不良反应的发生率,如外周水肿和血栓栓塞。抗HGF抗体利妥木单抗的研究中,显示DCR为60%,PFS为2.6个月。
参考文献:
J Clin Med. 2020;9(11): 3543.京东健康互联网医院医学中心
作者:卢秀玲,毕业自北京大学公共卫生学院,曾在某知名医学网站担任医学总编辑,负责过肿瘤、心血管、内分泌等多个频道的内容产出。
-
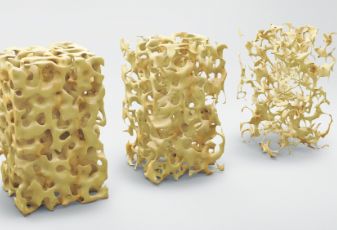
卫生部在上世纪90年代就提到了中国人日常钙离子的摄取不足问题,自此就掀起了全国人民一起补钙的风潮。虽然现在人们的生活条件和饮食结构都有很大的改善,每日钙的摄取量也有了一定的增长,然而骨质疏松的患者人数却是持续走高。

根据18年的骨质疏松疾病的相关调查显示,50岁以上人群患上骨质疏松的概率接近20%,男性骨质疏松的概率在6%左右,而女性的患病率要远远高出同年龄的男性,高达30%以上。65岁以上的女性更是多达52%的骨质疏松率。即使人们对补钙的越来越重视,但离预计的目标距离还是很远,怎样才能减少骨质疏松的患病率呢?人们的眼睛单单盯着补钙,其实除了补钙,维生素D3和维生素K也是补钙的重要元素。维生素K2是一种溶于脂的维生素,它可以起到让钙附着到我们的骨头上的作用,而且是人体中不可或缺的维生素之一。而且想要钙充分发挥强健骨质的作用,就需要维K来合成骨骼所需的骨钙蛋白。
维生素K促进骨质的生成如果身体中缺乏维生素K,那么质量欠佳的骨钙蛋白就会相应地增多。这样不仅会导致骨骼对钙质的吸收困难,还会让钙质从骨骼中析出,长时间下去骨骼会变得越来越脆弱。想要维持骨骼健康的状态,平时就要有意识地从食物中摄取维生素K,比如莴苣和纳豆等。
维生素K之间还是有区别的,大致分为K1和K2两种,维K1大都存在天葵、明日叶、同号等深色蔬菜当中。而维K2则大多是由微生物产出,所以上面提到的纳豆就是补充益生菌的高维K2食品。这种维生素被实验证明能增加骨量,还能在一定程度上预防骨质疏松,而且常被临床上当做治疗手段。纳豆除了含有丰富的维生素之外,还有其他的护骨成分。比如大量的蛋白质、钙离子、还有矿物质镁,还有能促进女性荷尔蒙分泌的异黄酮。还没有吃过纳豆的人可以尝试一下,可以趁这个机会尝尝鲜。

除了维生素K2,镁也是守护骨头健康必不可少的物质正常成年人的体内大概含有30克的镁,而六成都用来保证骨质健康。如果镁元素的摄入不足时,就会让体内钙质的合成处于失衡的状态,这是骨头就会异常脆弱。所以在日常意识中要增加镁的摄取,比如多吃坚果、海藻、以及绿叶蔬菜等。
-

视频简介
作者:郑州市第二人民医院 中医外科 主治医师 朱亚辉各大平台上的运动步数,大家应该都了解,不少人把每天步行1万步当做运动目标。
步数达到便说明,今天的运动量达标,对身体好;若没达到,当天运动量就不够。那么,日行万步,对身体是真的好吗?
展开更多









