简称:鹤壁市淇雅口腔门诊部
-

根据世界卫生组织报告,2018年有210万例新发肺癌病例,其中土耳其、日本、中国、美国和英国的发病率最高。肺癌是一组异质性肿瘤,分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)。包括50多种不同的组织学亚型,例如,NSCLC又分为腺癌、鳞状细胞癌和大细胞癌。
近年来,肺癌治疗取得了相当大的进展,最初仅限于细胞毒化疗。化疗药物阻断细胞周期,攻击快速分裂的细胞。这种传统的治疗方法特异性较低,既会攻击正常细胞,也会攻击癌细胞,导致显著的副作用。癌症治疗的最新进展包括靶向治疗,这种药物可以阻断仅在肿瘤细胞中过度表达或过度活跃的特定分子。靶向治疗大致有三种类型:单克隆抗体、小分子抑制剂和免疫毒素。
肺癌治疗的突破主要体现在患者5年生存率的提高上,从20世纪70年代早期的10.7%上升至21世纪10年代的19.8%。然而,仍然存在一些挑战,如发现新的驱动基因改变,了解耐药机制,发现新疗法的疗效预测因子。NSCLC约占所有肺癌病例的85%,近年来晚期肺癌的治疗经历了从细胞毒性治疗到靶向治疗的转变,下文将重点关注NSCLC的治疗新靶点。
抗EGFR药物
表皮生长因子受体(EGFR)基因是NSCLC的主要驱动基因之一。2016年的一项荟萃分析发现,约32.3%的NSCLC肿瘤存在EGFR基因突变。这种突变在女性中(比男性高19.7%)、亚洲人(比北美人群高52%)、非吸烟者(比过去或者当前吸烟者高27.8%)和腺癌患者中(比其他组织类型高26.3%)更为常见。
抗EGFR治疗包括酪氨酸激酶抑制剂(TKI),是结合EGFR受体的靶向药物。第一代药物以可逆的方式与EGFR的ATP位点结合并抑制磷酸化,阻断EGFR相关的信号通路。第二代TKI通过引起EGFR的催化结构域的共价修饰,不可逆地阻断了该蛋白的酪氨酸激酶活性。第一代TKI包括厄洛替尼、吉非替尼和埃克替尼;第二代TKI包括阿法替尼和达克替尼。各种III期临床试验均显示出,晚期NSCLC中第一代和第二代TKI相比铂类化疗的益处。
第一代和第二代TKI的疗效取决于EGFR所携带的突变。大约70%的EGFR突变肿瘤对TKI有临床反应;剩下的30%对TKI药物一开始就耐药(称为原发耐药),对TKI治疗没有反应,与EGFR外显子20复制或其他突变有关,如PTEN和PIK3CA。尽管有良好的结果,第一代和第二代TKI有相当大的毒性。这些药物可能引起诸如口腔炎、腹泻、皮疹和甲沟炎等副作用,约40%的人群需要降低剂量。
靶向T790M的药物
为克服T790M导致的耐药,奥西替尼、美雷替尼和rociletinib等第三代TKI药物应运而生。这些药物不可逆地与T790M突变的EGFR蛋白高效结合,有效抑制癌症生长,第三代TKI的毒副作用更少。III期AURA研究发现,与NSCLC的标准化疗相比,奥西替尼的PFS增加了5.7个月,疾病控制率(DCR)增加了19%。FLAVUR 的 III期研究比较了奥西替尼和第一代TKI,发现PFS有所增加,从10.2个月延长到18.9个月。
ALK抑制剂
在NSCLC患者中,间变性淋巴瘤激酶(ALK)基因突变也是是药物治疗的常见靶点,约有5%的患者存在这种突变。克唑替尼是一种ALK抑制剂,在一项开放标签的3期临床试验中,针对ALK阳性晚期NSCLC的一线治疗,对克唑替尼与标准化疗的疗效进行了比较。结果显示,与化疗组相比,克唑替尼组的PFS明显更长(10.9个月vs. 7.0个月),然而,中位总生存期却没有显示出显著优势。克唑替尼组有恶心、疲劳、呕吐、食欲减退等不良反应。III期PROFILE 1014试验,也比较了克唑替尼与化疗作为ALK阳性NSCLC患者的一线治疗方案的疗效。克唑替尼每天两次,每次250mg;化疗组给予培美曲塞500 mg/m2 +顺铂75/m2或卡铂静脉注射,每3周一次,最多6个周期。结果显示,克唑替尼组的中位总生存期尚未达到,而常规化疗组的中位总生存期为47.5个月。
阿来替尼是一种高选择性ALK抑制剂。在一项随机、开放标签的3期临床试验中,研究者比较了阿来替尼(600mg,每日2次)和克唑替尼(250mg,每日2次)对ALK阳性NSCLC患者的疗效。结果显示阿来替尼组的PFS率较高(68.4% vs. 48.7%)。与克唑替尼相比,阿来替尼组的3级或5级不良事件更少(41% vs 50%)。
一项随机III期试验招募了303名以前未接受过化疗的患者,接受阿来替尼(600mg,每日两次)或克唑替尼(250mg,每日两次)治疗。在中位随访17.6个月(克唑替尼)和18.6个月(阿来替尼)期间,阿来替尼组和克唑替尼组疾病进展发生率分别为41%和68%。在阿来替尼组中有82.9%的患者有缓解,克唑替尼为75.5%。阿来替尼组3 - 5级不良事件发生率较低(41 vs 50%)。
c-MET抑制剂
c-MET蛋白是NSCLC进展的另一个关键因素,使其成为新的希望靶点。靶向c-MET激活机制的药物是治疗NSCLC的重要手段,这些药物包括MET酪氨酸激酶活性抑制剂(克唑替尼,特泊替尼,卡马替尼),针对MET(奥那妥组单抗)或HGF (利妥木单抗)的单克隆抗体。
AcSe II期试验发现,克唑替尼用于MET突变患者的ORR为36%,MET扩增患者的ORR为32%。METROS II期试验发现,接受克唑替尼治疗的MET突变或扩增患者的中位ORR为27%,PFS为4.4个月。
对卡马替尼的试验显示了更有希望的结果。卡马替尼主要靶向扩增和第14外显子突变的MET。GEOMETRY Mono-1试验研究了卡马替尼在晚期NSCLC中的疗效,结果显示ORR为71.4%,缓解持续时间为8.41个月。该研究还发现,与之前治疗的患者相比,既往未治疗过的患者PFS高了近4个月。
在对MET扩增和EGFR突变患者进行分析的II期JO28638试验中,与厄洛替尼相比,奥那妥珠单抗的ORR为68.9%,PFS为8.5个月。另一项对奥那妥珠单抗+贝伐珠单抗+培美曲塞进行的研究发现,加用奥那妥珠单抗并不能带来益处,只会增加不良反应的发生率,如外周水肿和血栓栓塞。抗HGF抗体利妥木单抗的研究中,显示DCR为60%,PFS为2.6个月。
参考文献:
J Clin Med. 2020;9(11): 3543.京东健康互联网医院医学中心
作者:卢秀玲,毕业自北京大学公共卫生学院,曾在某知名医学网站担任医学总编辑,负责过肿瘤、心血管、内分泌等多个频道的内容产出。
-

一说到癌症,很多人都以为离自己很远。
你的每一口烟酒,都给了癌症一次找上你的机会。据媒体报道,癌症的发生正呈低龄化趋势。在近40年的时间里,不同年龄阶段的年轻人整体患癌比例呈上升趋势,也就是说,癌症的魔爪正伸向越来越多的年轻人。现代人的生活方式越来越丰富多样,正因如此,也让病毒有了可乘之机。无论是烟草、酒精,还是常吃的加工食物,都大大提高了患癌的风险。要认识到不良习惯与癌症的关系,还得从癌症的成因说起…

癌症是怎么找上门的?

每次吸烟 喝酒 ,我们的血液中就会残留这些致癌物,所以哪怕只是一根烟、一口酒,也相当于给了癌症一次诞生的机会。
五个习惯,都在给癌症机会
烟草
烟草烟雾中,检测出含有可致癌物69种。
如果戒烟,立马就有好处:
戒烟20分钟,因吸烟而过快的心率降下来
戒烟半天,血液中的一氧化碳含量就逐步恢复正常了
戒烟2周~3个月,患心脏病的风险开始下降,肺功能开始改进
戒烟1~9个月,咳嗽和气短现象减少
戒烟1年,因吸烟所增加的冠心病风险降低一半
戒烟10年,肺癌死亡率降低一半,患口腔癌、喉癌、食道癌、膀胱癌、肾癌、胰腺癌的风险逐渐下降

2个事实
1.二手烟也有致癌风险
电子烟的危害不比传统烟草小
2.酒精
和不饮酒者对比,饮酒者患各种癌症的概率都会增大。
3个事实
1.少量酒精摄入照样会伤害身体
2.喝酒容易脸红的更不能喝
喝酒助眠只是错觉
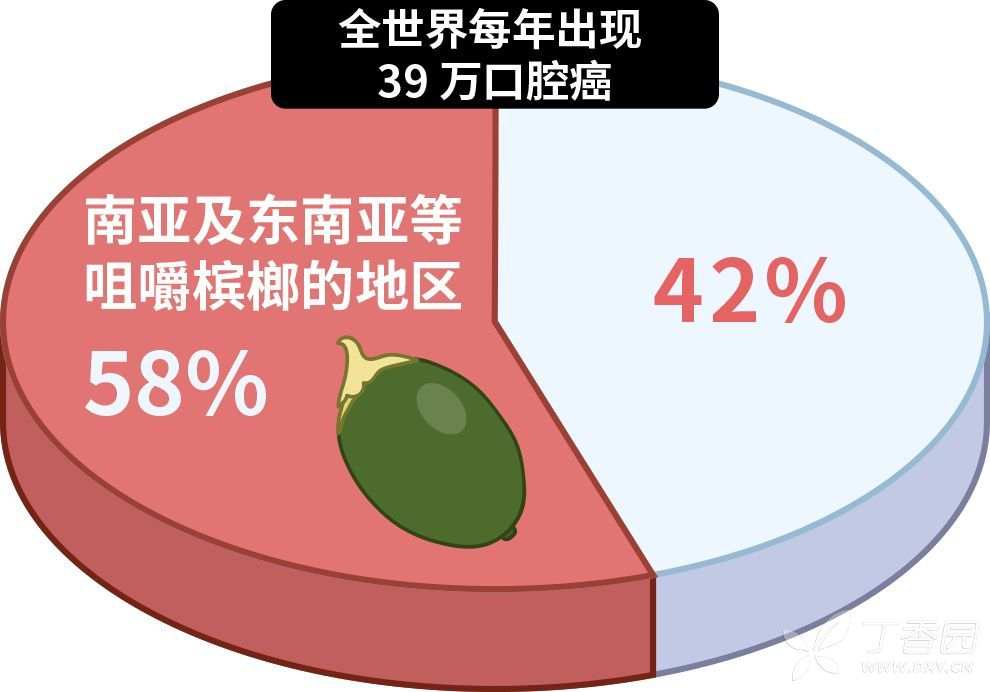
3.槟榔
槟榔是口腔癌最大的诱因,经常嚼槟榔,患口腔癌的几率大大增加。
2点事实
1.槟榔加烟,更易患口腔癌
2.没有混入烟草的槟榔一样致癌
加工肉
每天几口加工肉,就能让患癌风险增加。
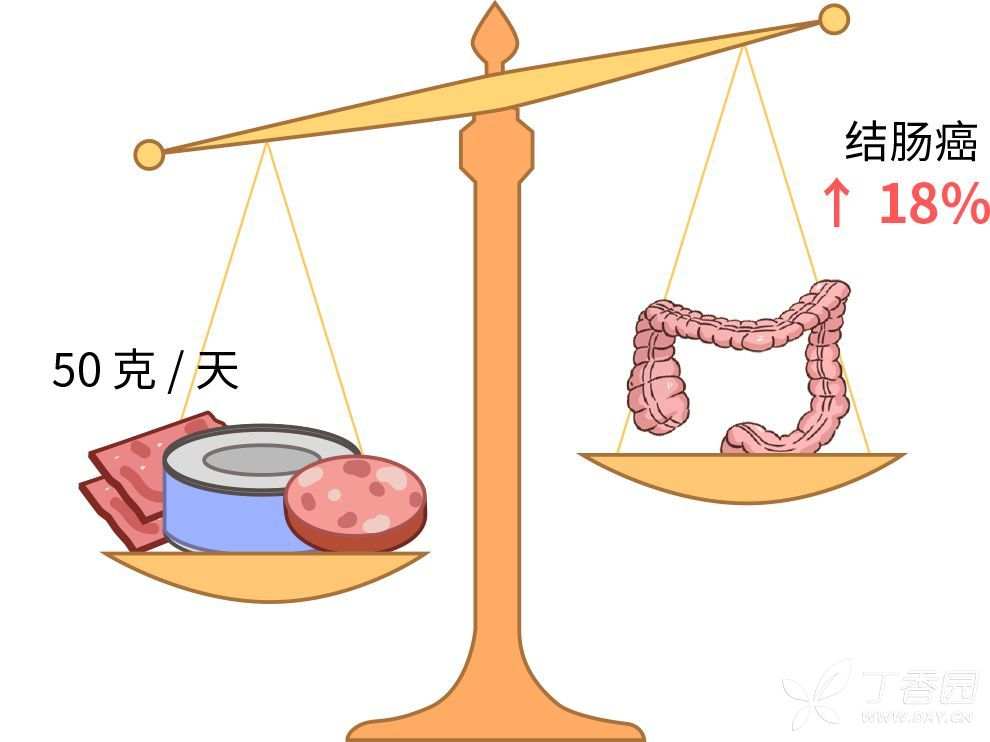
3个事实
1.加工肉往往钠含量超标
2.摄入过量盐也是癌症高发的原因之一
尽量少吃,偶尔解解馋就好
3.黄曲霉毒素
目前最强的致癌物,毒性是砒霜的 64 倍。

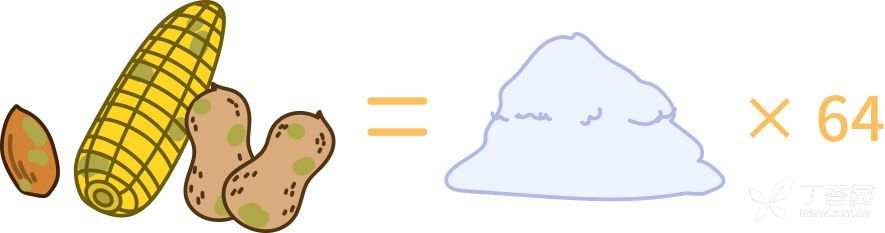
2个事实
1.加热或许可以杀死霉菌,但仍难以消除毒素
2.去掉发霉部分不能避免危害,应该直接扔掉
其实不用谈【癌】色变

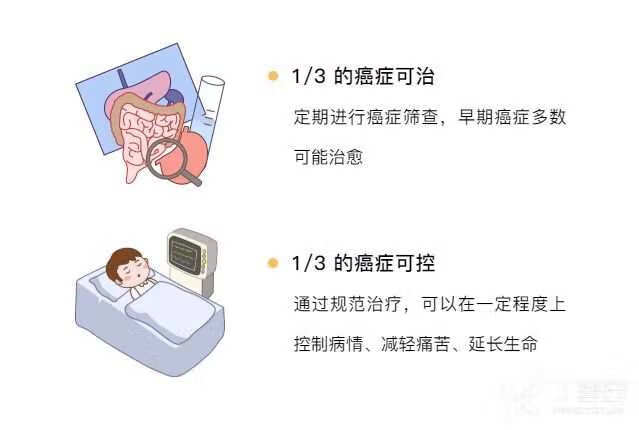
-
免疫疗法,主要是靶向PD-1或PD-L1的免疫检查点抑制剂,已成为大多数晚期肺癌患者的标准治疗方法,与化疗相比具有生存优势,且副作用更低。在短短的时间内,PD-1和PD-L1抑制剂已经从一种有希望的挽救性疗法,变为晚期非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)的标准一线治疗策略,是局部晚期不可切除NSCLC的重要治疗手段,也是早期NSCLC的一种潜在治疗策略。下文总结了免疫疗法在转移性非小细胞肺癌一线治疗中的应用。
PD-1/PD-L1单药用于转移性NSCLC一线治疗
KEYNOTE-024试验是首个建立了免疫治疗可用于NSCLC一线治疗的研究。这项全球性III期试验纳入了305例PD-L1高表达的IV期NSCLC患者,患者被1:1随机分配至派姆单抗或铂类化疗。中位随访时间为11.2个月,派姆单抗组的中位无进展生存期(PFS)为10.3个月,明显高于化疗组的6.0个月。KEYNOTE-024证明了 在PD-L1高表达的转移性NSCLC患者中,一线治疗使用派姆单抗比化疗更有生存优势,FDA于2016年批准了该适应症。
IMpower 110试验探讨了阿特珠单抗在PD-L1阳性NSCLC患者一线治疗中的作用。这项III期试验纳入了572名患者,被1:1随机分配到阿特珠单抗组或化疗组。中位随访15.7个月,在PD-L1高表达人群中,阿特珠单抗组的表现优于化疗,阿特珠单抗组的中位总生存期(OS)为20.2个月,化疗组为13.1个月。 2020年5月,FDA批准阿特珠单抗用于PD-L1高表达晚期NSCLC患者的一线治疗。
双免疫检查点抑制剂用于转移性NSCLC的一线治疗
除了PD-1/PD-L1抑制剂外,另一种成功的免疫检查点抑制剂是CTLA-4抑制剂,如伊匹单抗是黑色素瘤和肾细胞癌的标准治疗组成。基于CheckMate 227试验显示出的疗效,也已成为NSCLC的标准一线治疗选择。
CheckMate 227试验纳入了既往未治疗过的NSCLC患者。1189名表达PD-L1的患者被随机分配至联合免疫治疗(纳武单抗 3mg/kg,伊匹单抗1mg/kg),纳武单抗单药治疗(240 mg),或铂类化疗。550名无PD-L1表达的患者,随机接受纳武单抗+伊匹单抗治疗,纳武单抗(360mg)联合化疗,或铂类化疗。
在PD-L1阳性组中,联合免疫治疗组优于化疗组,中位OS分别为17.1个月和14.9个月。 2020年5月15日,纳武单抗+伊匹单抗联合治疗被FDA批准用于PD-L1阳性晚期NSCLC的一线治疗。
化疗+免疫治疗用于晚期非鳞状NSCLC的一线治疗
另一种在肺癌治疗中获得成功的免疫治疗策略是将 PD(L)1抑制剂与化疗联合使用,这种策略对PD-L1阴性肿瘤也有效。目前已有许多组合被发现有效,化疗+免疫疗法策略已被证明有效且耐受性良好。
第一个被批准的肺癌化疗-免疫治疗方案是基于KEYNOTE-021G试验,该研究探讨了铂类化疗加上派姆单抗的疗效。在这项随机II期研究中,123例未经治疗的EGFR和ALK野生型、非鳞状NSCLC患者被随机分配到卡铂加培美曲塞组或化疗加派姆单抗组。结果显示,卡铂和培美曲塞的基础上加入派姆单抗可改善患者缓解率(58% vs. 33%)、PFS(24.5 vs. 9.9个月)和OS(34.5 vs. 21.1个月)。 派姆单抗+卡铂和培美曲塞方案于2017年5月10日获得FDA加速审批。
该方案的确证性III期试验为KEYNOTE-189,该研究以2:1的方式将616名既往未经治疗、EGFR和ALK野生型、非鳞状NSCLC患者随机分配至每3周一次的派姆单抗 200 mg组或安慰剂组,并加上4个周期的顺铂或卡铂加培美曲塞。中位随访23.1个月的结果显示,一线治疗中派姆单抗联合化疗改善了患者的生存率,卡铂+培美曲塞+派姆单抗的中位OS为22.0个月,化疗+安慰剂为10.7个月。基于该研究, FDA于2018年8月20日批准派姆单抗+铂类+培美曲塞用于非鳞状NSCLC的一线治疗。
一线化疗加上阿特珠单抗,也能改善患者结局。在IMpower 130试验中,724例既往未治疗的晚期非鳞状NSCLC患者以2:1的比例被随机分配至阿特珠单抗(1200mg)或安慰剂组,同时给予卡铂和白蛋白紫杉醇。中位随访18.5个月,阿特珠单抗组的生存期更好,中位OS为18.6个月,安慰剂组为13.9个月。 阿特珠单抗联合卡铂+白蛋白紫杉醇于2019年12月3日获得FDA批准。
另一个引人注目的免疫治疗策略是 化疗-免疫治疗再加上血管生成抑制剂。IMpower 150试验探讨了一线化疗中加入贝伐珠单抗和阿特珠单抗的疗效。既往未接受过治疗的非鳞状NSCLC患者接受四个周期的卡铂和紫杉醇治疗,并随机1:1:1接受贝伐珠单抗单药、阿特珠单抗单药或贝伐单抗联合阿特珠单抗。
结果显示,阿特珠单抗、贝伐珠单抗、卡铂和紫杉醇4药方案组的中位PFS为8.3个月,OS为19.2个月,优于贝伐珠单抗+卡铂+紫杉醇组(中位PFS为6.8个月,中位OS为14.7个月)。与其他研究类似,该方案在不同PD-L1表达水平的患者中均有获益。 阿特珠单抗+贝伐珠单抗+卡铂+紫杉醇的方案于2018年12月6日获得FDA批准,作为晚期非鳞状NSCLC的一线治疗策略。
化疗+免疫治疗用于晚期鳞状NSCLC的一线治疗
化疗+免疫治疗也能改善鳞状NSCLC患者的结局。KEYNOTE-407试验将559例未经治疗的鳞状NSCLC患者随机分配至派姆单抗或安慰剂组,并同时给予化疗(卡铂加紫杉醇或白蛋白紫杉醇)。结果显示,化疗基础上加入派姆单抗改善了患者生存期,中位OS为15.9个月,单纯化疗组为11.3个月,在不同PD-L1表达水平的患者中均有获益。 派姆单抗联合卡铂和紫杉醇或白蛋白紫杉醇于2018年10月30日被FDA批准为晚期鳞状NSCLC患者的一线治疗方案。
然而,研究显示, 卡铂和白蛋白紫杉醇基础上加用阿特珠单抗并不能改善鳞状NSCLC患者的总生存。在IMpower 131试验中,未经治疗的晚期鳞状NSCLC患者被1:1:1随机分配至卡铂和白蛋白紫杉醇加阿特珠单抗组,卡铂和紫杉醇加阿特珠单抗组,或卡铂和白蛋白紫杉醇组。结果显示,加上阿特珠单抗后PFS有所改善,但对总生存期没有改善,加用阿特珠单抗的中位OS为14.2个月,单纯化疗组为13.5个月。
参考文献:
J Surg Oncol. 2021 Mar;123(3):718-729.
京东健康互联网医院医学中心
作者:卢秀玲,毕业自北京大学公共卫生学院,曾在某知名医学网站担任医学总编辑,负责过肿瘤、心血管、内分泌等多个频道的内容产出。
-

全球范围内,三分之一的女性死亡原因是缺血性心脏病(IHD)。虽然育龄女性IHD的患病率较低,但就目前的趋势而言,如孕妇年龄增加,孕妇糖尿病、肥胖和高血压患病率增加,可能导致了这类群体中冠状动脉疾病的患病率增加。此外,有研究证实,怀孕本身就会比同龄非怀孕女性的急性心肌梗死(AMI)风险更高。心脏病是孕产妇死亡的主要原因,IHD占心脏病病因的五分之一以上。
妊娠期心肌梗死的患病率
据报道, 妊娠期心肌梗死的发病率为6.2/10万妊娠。动脉粥样硬化仍然是妊娠期AMI的最主要原因,其他原因也比非妊娠人群更为常见。孕妇AMI的各种病因患病率如下:冠状动脉粥样硬化伴或不伴冠状动脉内血栓(27%–40%)、自发性冠状动脉夹层 (SCAD,27%–43%)、冠状动脉内血栓不伴动脉粥样硬化(8%–17%),冠状动脉痉挛 (2%)。
对2006-2011年间150例AMI患者的类型和时间进行分析发现,大多数患者表现为ST段抬高型心肌梗死(STEMI,75%),其余患者表现为非ST段抬高型心肌梗死(NSTEMI)。大多数事件发生在妊娠晚期(STEMI,25%;NSTEMI,32%)或产后(STEMI,45%;NSTEMI,55%)。梗死累及左室前壁(69%)、下壁(27%)、侧壁(4%)。
冠状动脉疾病的药物治疗和孕期安全性
大多数用于IHD的药物,不管是治疗AMI或用于心血管疾病的二级预防,可以在怀孕和哺乳期间继续使用,但有一些药物例外。如果有致畸性或其他对胎儿有害的影响,建议停止该药物。此外,可能需要调整药物剂量,因为妊娠期间的血流动力学变化会影响药代动力学。 他汀类药物在孕期和哺乳期禁用,但是这些女性在孕期和产后停药,发生AMI的风险可能会增加。
使用冠状动脉造影的注意事项
对于急性斑块破裂导致的STEMI,建议通过经皮冠状动脉介入治疗(PCI)和支架植入及时进行冠状动脉再灌注。基于妊娠期间事件发生的时间以及出血风险,选择药物洗脱支架(DES)还是裸金属支架(BMS)。DES再狭窄的风险较低;然而,与BMS相比,会需要更长时间的抗血小板药物治疗(12个月vs 1个月)。考虑到BMS可缩短抗凝治疗时间,BMS可能是有优势的,尤其是在分娩期间。
血管造影是妊娠期IHD诊断的金标准。然而,只有60%的AMI女性接受了冠状动脉造影,部分原因是担心会对胎儿产生危险。目前可接受的妊娠期辐射累积剂量为50mGy,一个重要影响因素是妊娠所处时期。在妊娠的头2周,无论辐射剂量多大,都可能导致自发流产。妊娠第3周到第8周,出生缺陷、流产或生长迟缓的风险较低,除非辐射量超过200 mSv。妊娠8至15周,对中枢神经系统(CNS)的风险较高,包括小头畸形和其他CNS畸形,辐射阈值为300 mSv。
重组组织型纤溶酶原激活剂进行溶栓
在无法进行PCI的情况下,必要时可考虑使用组织型纤溶酶原激活剂(TPA)。以前人们认为妊娠期间应禁止溶栓,但新数据表明,妊娠期使用TPA的风险并不高于非妊娠女性。要注意的是,在冠状动脉夹层所致心肌梗死患者中,溶栓可能会加重出血和夹层。
妊娠期自发性冠状动脉夹层
普通人群中,自发性冠状动脉夹层(SCAD)并不是AMI的常见病因; 但妊娠期AMI中 ,SCAD可占到27%-43%。SCAD的典型表现与AMI相似,伴有胸痛、呼吸困难和出汗。SCAD诊断通常比较困难,因为典型患者通常是年轻人,没有其他可识别的心血管危险因素。
基于研究的发现,对于患有纤维肌发育不良(25%–86%)、处于妊娠期(2%–8%)、有结缔组织疾病(1.2%–3%)、全身炎症(<1%–8.9%)、服用外源性激素(10.7%–12.6%)和诱发应激事件的患者,应怀疑SCAD的可能性。超过50%的患者会报告有促发因素,包括分娩、服用外源性激素、高强度运动。妊娠期SCAD的潜在机制尚不完全清楚,可能是妊娠期间动脉壁激素减弱时血液动力学压力增加的结果。
自发性冠状动脉夹层最初的临床表现为心源性休克(2%-5%)、STEMI(26%-87%)、室性心律失常或心源性猝死(3%-11%)。在一项包括168名患者的队列研究中,所有患者都出现了肌钙蛋白I水平升高。患者的左心室射血分数通常保持不变,但超声心动图或早期血管造影可发现左心室壁运动异常。
任何动脉都可能受到影响, 左前降支最常见,可占到32%-46%。与非孕期SCAD的管理类似,建议大多数孕妇采用 保守治疗并住院监测。在一项包括131例SCAD病例的观察性研究中,自发性愈合率为88.5%,35天后,所有患者的血管造影均观察到愈合。在需要做血管造影的病例中,需要注意球囊膨胀或支架扩张所产生的径向力可能导致夹层;在PCI前对SCAD提高警惕是有必要的。
在对孕期自发性冠状动脉夹层 (P-SCAD)与非孕期自发性冠状动脉夹层 (NP-SCAD)的比较中,P-SCAD更多表现为急症,包括STEMI (57% vs 36%),左主血管或多血管SCAD (24% vs 5%),以及左心室功能≤35% (26% vs 10%)。
P-SCAD最常发生在产后第一个月。在2000-2015年进行的一项荟萃分析中,有超过120例发生了妊娠期SCAD,超过87名患者(72.5%)发生在产后第3天至第210天之间。与NP-SCAD相比,P-SCAD患者伴有纤维肌发育不良和冠状动脉外血管异常的可能性更小。
临床诊疗建议
1. 已有IHD的女性应在怀孕前接受全面的心脏评估。
2. 现有的工具如CARPREG Ⅰ、CARPREG Ⅱ、ZAHARA和改良WHO分类,通常可用于先天性心脏病、瓣膜病和心肌病的评估,但在IHD女性的风险评估中作用有限。
3. 从现有趋势来看,如孕妇年龄偏大、合并症患病率增加,可能导致妊娠期IHD的发病率增加。
4. 识别和治疗妊娠期间自发性冠状动脉夹层和冠状动脉痉挛非常重要,因为其临床表现可能不典型。
5. 大多数用于IHD或心血管疾病二级预防的药物可以在怀孕期间继续使用,但某些药物除外。
参考文献:
Cardiol Clin. 2021;39(1):91-108.京东健康互联网医院医学中心
作者:龚志忠,首都医科大学硕士,研究生期间在北京安贞医院主要从事心血管病流行病学研究,已参与发表英文SCI论文2篇,中文核心期刊论文3篇,参与编写出版著作2部。
-
有网友在网上平台咨询:病人确诊晚期肺癌,肺穿刺病理是小细胞肺癌,但有腺癌成分,是否可以靶向治疗?
肺癌中恶性程度最高的是小细胞肺癌(SCLC),占了 15%~20%。而在小细胞肺癌中有部分是小细胞肺癌与非小细胞肺癌(NSCLC)成分相混合的,称为复合型小细胞肺癌。其中的非小细胞肺癌成分可以为鳞癌、腺癌、大细胞神经内分泌癌、梭形细胞癌、巨细胞癌等等,以混合鳞癌最常见,混合成分可以是一种或多种。复合型小细胞肺癌总的发生率(活检+手术)占小细胞肺癌的2%-24%。在小细胞肺癌的术后病理诊断中,复合型小细胞肺癌为12%~28%,而细胞学或组织活检标本中仅为8.6%,这是由于支气管镜和肺穿刺所取标本太少,导致复合型小细胞肺癌诊断率不高。可见标本采集数量和完整性对于发病率不高的复合型小细胞肺癌的诊断十分重要。

复合型小细胞肺癌临床特点与纯小细胞肺癌相似,常见于中老年伴有长期吸烟史的男性,男性约占发病总人数的 70%,中位发病年龄60岁,中央型肺癌约占80%,处于晚期约占80%。目前发现复合型小细胞肺癌与鳞癌有更为紧密的组织联系和起源关系,且两者均来源于鳞状上皮细胞基底细胞层,发生部位一致,多表现为中央型团块病灶,且合并纵隔、肺门多组淋巴结肿大,肿大淋巴结可压迫纵隔内动脉、静脉、食管、肺组织及周围组织等重要器官,造成上腔静脉阻塞、食管受压及肺不张等表现,少部分患者的肺部病灶呈孤立结节或浸润性改变,亦可合并有胸腔积液和心包积液。
2014年美国NCCN推荐把复合型小细胞肺癌列入小细胞肺癌的分支中,在治疗复合型小细胞肺癌方面无明确及统一的治疗方案,目前的各大指南都将复合型小细胞肺癌归为小细胞肺癌的范畴,采用相同的治疗模式。
1.对于早期(T1-2N0M0)的复合型小细胞肺癌主要治疗为手术联合放、化疗,术后辅助化疗及放疗患者在生存率上获益。
2.对于高于T1-2N0的患者主要治疗方式为化疗+放疗,标准化疗方案为EP(依托泊苷+顺铂)及EC(依托泊苷+卡铂)。效果较好的患者可考虑预防性脑部放疗。
3.广泛期患者首选联合化疗,体力状况较差的患者选择最佳支持治疗。由于混杂了非小细胞肺癌的成分,复合型小细胞肺癌化疗敏感性低于纯小细胞肺癌,有效率在50%左右。

回到文章开头的问题,对于混杂有腺癌成分的小细胞肺癌能否考虑靶向治疗,首先必须先进行基因检测。有报道显示,EGFR突变在纯小细胞肺癌中发生率是4%,而在复合型小细胞肺癌中,可达到15%~20%,一般发生在无吸烟史且混合腺癌成分的患者中。对这类患者靶向治疗可能能够获益,但目前无大样本的临床试验支持。如果病人体质弱,拒绝化疗,在有敏感基因突变的前提,可以使用相对应的靶向治疗。如果没有敏感基因突变,也可以考虑抗血管生成靶向药安罗替尼,但使用期间需密切关注出血风险。
-



参考文献:
[1]丁盛玲.盆底重建术的术前与术后护理体会[J].中国临床保健杂志,2011,14(04):445.
[2] 张志霞,顾雪敏,李怀芳.加速康复外科在盆底重建围手术期中的应用进展[J].同济大学学报(医学版),2021,42(06):846-852.
[3]石俊静,职梅,路萍.围术期护理对行盆底重建术治疗的盆底功能障碍性疾病女性患者的干预效果[J].慢性病学杂志,2021,22(06):877-879.DOI:10.16440/j.cnki.1674-8166.2021.06.016.
-

急性肾损伤(AKI)是指发生在数小时或数天内的肾功能突然下降。它是住院患者的常见并发症,与死亡率增加、住院时间延长和其他不良后果有关。目前已经成为一个全球性的公共卫生问题,成人发病率约为11.6%-18.3%,儿童发病率为19.6%-26.9%。接触具有肾毒性的药物是医源性AKI的常见原因,占儿童AKI总发病率的很大一部分。避免不当使用有肾毒性的药物是预防儿童医源性AKI的重要方式。
今天要说的布洛芬是一种非甾体抗炎药(NSAID),是环氧合酶的非选择性阻滞剂。它经常用于儿童疾病,包括发热、术后疼痛、肿瘤和炎症性疾病,如儿童特发性关节炎和川崎病。作为环氧合酶活性的阻滞剂,布洛芬抑制前列腺素的合成,导致血管收缩,肾小球前阻力增加,肾脏减少。14作为环氧合酶活性的阻滞剂,布洛芬抑制前列腺素的合成,导致血管收缩,肾小球前阻力增加,肾灌注减少,肾前AKI风险增加。之前的一项研究显示,使用非甾体抗炎药与中国儿童发生AKI的风险增加63%相关,占医源性AKI总风险的11%。
虽然布洛芬是世界上最常用的非甾体抗炎药,但很少有大型研究专门研究布洛芬与儿童医源性AKI之间的关系。此外,这些研究通常受到样本量小和报告结果不一致的限制。本文中的数据是建立在一个中国住院儿童的大型回顾性队列上,本队列研究了布洛芬的使用与医院获得性AKI风险之间的关联。
研究对象为2013年1月1日至2015年12月31日期间在中国25个三级医疗中心的1所住院的3044023例患者,最终选取了50240名患者纳入研究对象(图1)。
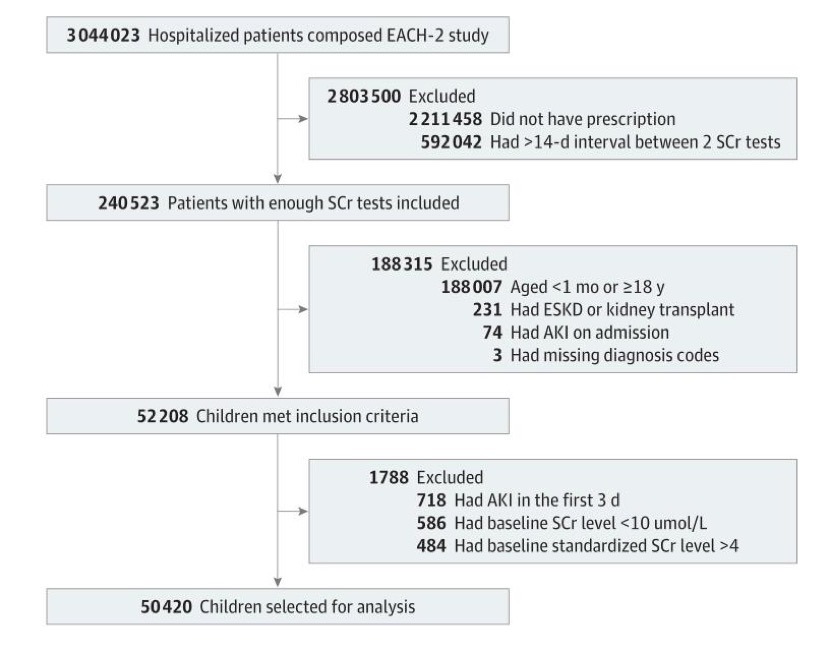
图1(图片来源于文献资料)
研究数据
-
图2总结了使用布洛芬分层的研究中儿童的人口学和临床特征。与非服药者相比,布洛芬服药者倾向于更年轻(平均[SD]年龄5.1[5.3]岁vs 4.2[3.9]岁),基线SCr水平更高(中位[IQR], 29 [21-41] μmol/L vs 31 [23-42] μmol/L);较长的LOS(中位[IQR], 14[10-21]天vs 18[12-29]天);呼吸道感染(13309 [29.7%]vs 2262[40.9%])、肿瘤(4783 [10.7%]vs 857[15.5%])和脓毒症(2295 [5.1%]vs 734[13.3%])的发生率更高;对重症监护的需求更大(4373例[9.7%]vs 851例[15.4%]);住院死亡率也更高(288 [0.6%]vs 134[2.4%])。利尿剂和质子泵抑制剂是最常见的伴随药物。在5526名布洛芬使用者中,检测到427例医院获得性AKI事件(7.7%),发生事件的中位时间(IQR)为9(6-14)天。
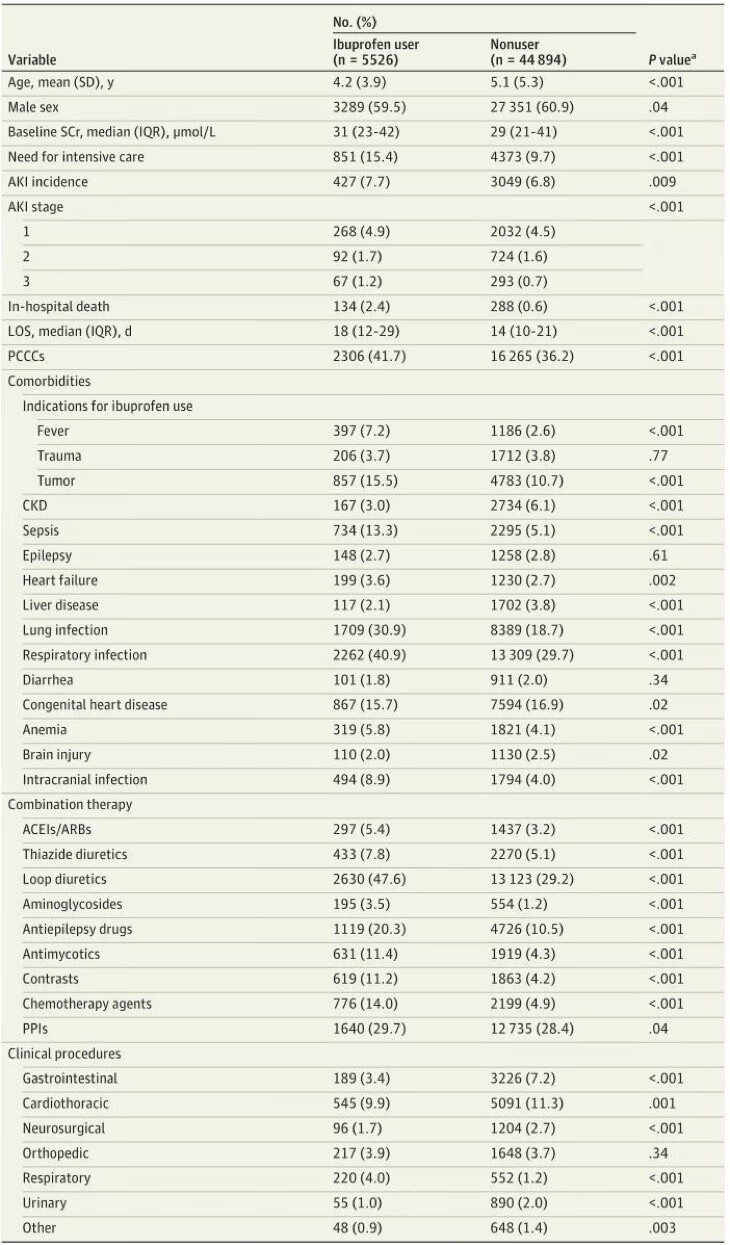
图2(图片来源于文献资料)
-
使用布洛芬与医院获得性AKI风险显著增加相关(风险比[HR], 1.23;95% CI, 1.14-1.34)。各亚组的关联分析结果见图3。布洛芬在年龄较大的儿童(>10岁;调整后的HR,1.64;95% CI, 1.32-2.05),伴有CKD(调整后的HR, 2.31;95% CI, 1.73-3.10),以及需要重症监护的患者(调整后的HR, 1.47;95%可信区间,1.24 -1.75)。
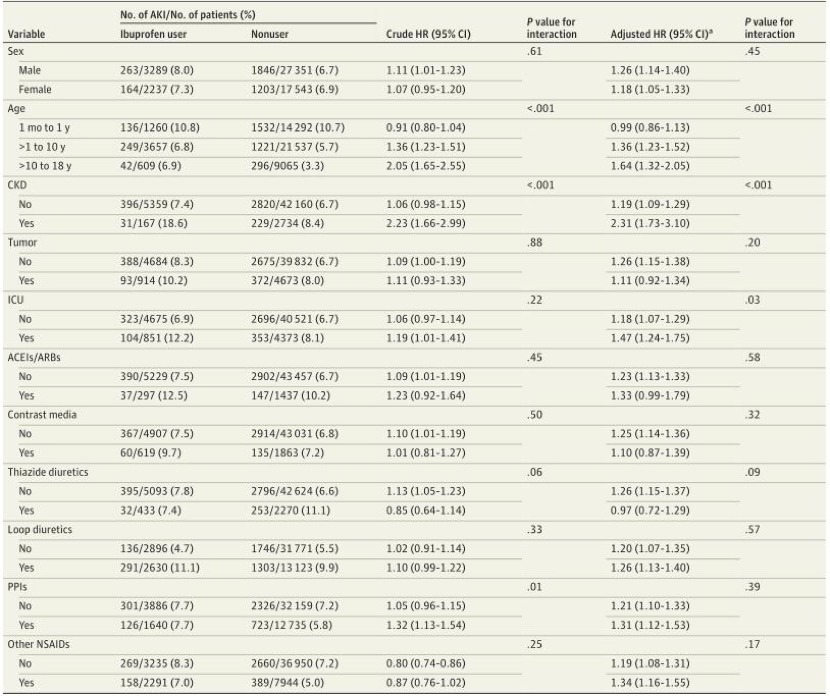
图3(图片来源于文献资料)
在布洛芬使用者中,布洛芬累积剂量的中位数(IQR)为12.13(5.59-32.36)mg/kg体重。AKI患儿布洛芬累积剂量较高,中位数为13.45(6.02-44.10)mg/kg,非AKI患儿12.02(5.55-31.15)mg/kg。剂量-反应曲线表明布洛芬暴露与AKI风险呈正相关,呈线性关系(图4)。
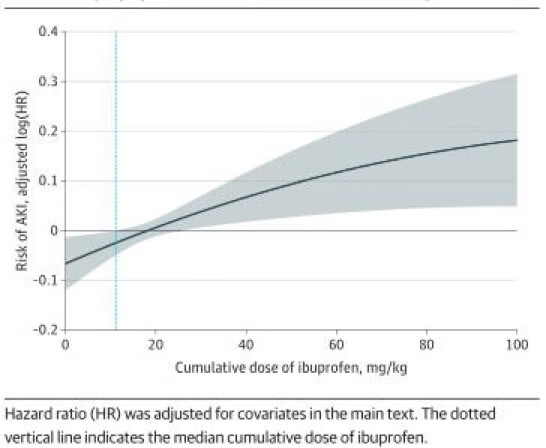
图4(图片来源于文献资料)
-
在第一次敏感性分析中,所有3种倾向得分匹配方法都产生了布洛芬使用者和非使用者的均衡配对,对于所有考虑的协变量,绝对标准化平均差值小于0.1(最大值为0.07)。第二种匹配方法产生了最多的匹配对,在随后的倾向得分匹配分析中使用了第二种匹配方法。在5240个倾向得分匹配的配对中,布洛芬的使用与医院获得性急性心肌梗死的风险显著增加相关。
-
在第二个敏感性分析中,使用Prock标准30来检测医院获得性AKI,该标准在识别真实AKI方面比KDIGO标准更准确。在这项分析中,观察到布洛芬对医院获得性AKI的影响更大(HR,1.38;95%CI,1.24-1.54)。
数据分析
-
在这项第一个针对中国儿童的大型、多中心、回顾性队列研究中,布洛芬在中国住院儿童中很常见,在调整混杂因素后,与医院获得性急性心肌梗死的风险显著增加相关。这种联系似乎是剂量依赖性的。在本研究的50420名儿童中,住院期间医院获得性AKI的发生率为6.9%,低于以往报道的发生率。这一差异可能与儿童的特征不同有关,如LOS、疾病严重程度、SCR检测频率和AKI检测方法。例如,研究人群来自所有住院儿童,医院获得性AKI的发病率预计将低于儿科重症监护的发病率。此外,研究人员还排除了社区获得性AKI(包括发生在住院前3天的AKI),并且没有尿量的计量数据,因此本研究可能低估了AKI的发病率。
-
在调整混杂因素后,布洛芬的使用与儿科医院获得性AKI风险增加23%相关(HR,1.23)。这种关联在倾向性得分匹配分析中以及在使用Prock标准检测儿童AKI的分析中被明确地观察到。在这项研究中,布洛芬对pROCK定义的AKI的估计HR大于KDIGO定义的AKI的估计HR(1.38比1.23)。与以前的研究结果一致,即KDIGO标准更容易将儿童中的虚假AKI归类为真AKI,从而冲淡了布洛芬使用的估计效果。
-
在研究人群中,患有CKD的儿童与没有CKD的儿童相比,使用布洛芬的风险更大(HR,2.31[95%CI,1.73-3.10]vs 1.19[95%CI,1.09-1.29]),需要重症监护的儿童比没有CKD的儿童(HR,1.47[95%CI,1.24-1.75]vs 1.18[95%CI,1.07-1.29]),或者年龄较大的与年轻的(>10岁或>1-10岁对1个月-1岁)(HR,1.47[95%CI,1.24-1.75]vs 1.18[95%CI,1.07-1.29])(。1.64[95%CI,1.32~2.05];HR,1.36[95%CI,1.23-1.51]vs 0.99[95%CI,0.86-1.13])。这些相互作用的确切机制尚不清楚。患有CKD的儿童体内药物浓度可能升高,而且发生AKI的危险因素较多的儿童可能更容易受到布洛芬潜在的肾毒性作用的影响。一项研究表明,在合并症较多的患者中使用布洛芬更有可能与AKI相关。在另一份报告中,与单独使用这两种药物相比,在儿童中联合使用布洛芬和对乙酰氨基酚与AKI的风险显著增加。然而,研究数据中没有发现布洛芬与其他类别药物的使用存在显著的交互作用,包括血管紧张素转换酶抑制剂和血管紧张素-II受体阻滞剂、利尿剂、质子泵抑制剂、其他非甾体抗炎药和造影剂。但是合理使用布洛芬和密切监测儿童肾功能是必要的。
总结
目前布洛芬被广泛使用于我国各级医疗机构中,对于中国儿童,特别是患有CKD或需要重症监护的儿童有较大影响,发生医源性AKI的风险显著增加,风险的大小与剂量大小呈现正比例。综合这些发现来看,布洛芬的长期应用应合理控制适应症和剂量,并密切监测儿童的肾功能。
参考文献:
1.Licong Su, MD; Yanqin Li,Association of Ibuprofen Prescription With Acute Kidney Injury Among Hospitalized Children in China 2021;4(3):e210775. doi:10.1001/jamanetworkopen.2021.0775
2. Uber AM, Sutherland SM. Acute kidney injury in hospitalized children: consequences and outcomes.PediatrNephrol. 2020;35(2):213-220. doi:10.1007/s00467-018-4128-7
京东健康互联网医院医学中心
作者简介:
李亮,湖北中医药大学博士,研究生期间主要从事于中医药慢性肾脏疾病防治的研究,已参与发表SCI论文3篇,中文核心期刊论文2篇,参与编写出版著作1部。
-
-

乳腺癌的风险因素有些可改变,有些不可改变。其中许多风险因素,如体重、锻炼和饮酒等,都属于可改变的生活方式危险因素,是适用于所有人包括乳腺癌高危人群可采取的预防措施。另一方面,对于乳腺癌高危人群来说,如果乳腺癌风险主要是由不可改变的风险因素驱动的,比如遗传家族史、乳腺密度高或良性乳腺疾病史,除了改变生活方式外,还需要考虑其他预防性治疗措施(如预防性手术),以降低他们的乳腺癌风险。
乳腺癌高危人群的一般建议
有或没有遗传易感性的女性
乳腺癌高危女性可分为两个亚组,有遗传倾向的女性和没有遗传倾向的女性。在这两类群体中,对乳腺癌风险的认知、心理影响、干预措施接受程度都不相同,因此必须采取 个体化预防策略。
多学科管理模式
对高危女性的干预措施很多都程度较大,而且是不可逆转的,例如,减少乳腺癌风险的预防性手术。因此,需要一个多学科小组进行管理,包括临床遗传学家、放射学家、心理学家、专业护士、乳腺外科医生、妇科医生和整形外科医生等。
生活方式改变
乳腺癌高危女性很多会选择预防性干预措施,但这些措施不能替代生活方式改变,即使采取了主要的预防性干预措施,乳腺癌的一些残余风险仍然存在。应在随访期、术后复诊时,与患者讨论生活方式改变的重要性。
药物预防措施
他莫昔芬等选择性雌激素受体调节剂(SERMs)和芳香化酶抑制剂(AIs)是乳腺癌内分泌治疗的主要药物。这两类药物对乳腺癌预防性治疗都有一定的作用。纳入3000多名参与者的9项III期试验的强有力证据显示, SERMs可使乳腺癌发病率降低约38%。
两项大型III期试验,IBIS-II和NCIC-MAP.3分别评估了阿那曲唑和依西美坦作为乳腺癌预防性治疗的效果,结果显示, AIs可降低至少50%的乳腺癌发病率,不过,这些益处仅限于预防ER阳性乳腺癌。主要的指南,如英国NICE指南、美国临床肿瘤学会(ASCO)指南、NCCN指南等,都建议医生与乳腺癌高危女性共同讨论预防性治疗策略。
长期获益
IBIS-I试验的长期随访结果(中位16年)值得关注,结果显示, 他莫昔芬在治疗后可持续降低乳腺癌的发病风险,有益作用在0-10年和10年后相似。这种较长的治疗后获益对预防性治疗策略有重要意义,而且副作用一般仅限于积极治疗期间。
有高危病变的女性获益更大
NSABP-P1试验显示,与试验中的总人群相比, 他莫昔芬对有非典型性增生女性的预防作用更大(乳腺癌风险降低:86% vs 49%)。在IBIS-II试验中,与无良性乳腺疾病的女性相比,预防性使用阿那曲唑可使有小叶原位癌(LCIS)、非典型性增生、乳腺增生的女性获得更大的益处。然而,在NCIC-MAP.3试验中,患有LCIS或非典型性增生的女性使用依西美坦获得的益处,与不伴有这些疾病的女性没有显著差异,不过该试验的中位随访时间更短,导致亚组分析的事件更少。 预防性治疗措施对有癌前病变/良性乳腺疾病的女性有更大的作用,可能也与他莫昔芬有长期持续性疗效有关。对AIs试验进行更长时间的随访将有助于探索这方面的问题。
对死亡率和肿瘤亚型的影响
没有一项乳腺癌预防性治疗试验是以乳腺癌事件或全因死亡率为终点设计的,因此,对死亡率的影响,无法得出有意义的结论。这些试验中发生的乳腺癌数量很少;由于乳腺癌存活率较高,乳腺癌死亡人数更少。此外,乳腺癌事件发生后的随访时间也不够长,如随访时间最长的IBIS-I试验的随访时间只有8年左右。对于ER阳性乳腺癌,需要更长的随访时间才能看到有意义的生存差异。
SERMs试验中观察到ER阴性肿瘤略多(160 vs 131)。目前,在AIs的试验中没有观察到这种差异性结果。 在不同肿瘤分期、不同淋巴结状态和不同肿瘤大小的亚组中,没有观察到他莫昔芬的疗效有显著差异。
研究显示在 预防ER阴性肿瘤方面缺乏益处,或此类肿瘤的发生率更高,应是BRCA1突变携带者使用他莫昔芬作为预防治疗的重要关注点,因为在这些女性中发生的乳腺癌,几乎有三分之二是ER阴性肿瘤。在BRCA2突变携带者中,这种担忧要更少。NSABP-P1试验的数据基于极少量的事件,显示他莫昔芬的获益似乎仅限于BRCA2携带者,BRCA1携带者缺乏获益。
手术预防 vs 药物预防
手术预防和药物预防的重要区别在于风险降低的程度和可逆性/不可逆性,药物预防可以灵活进行,在出现副作用时可以停止,但手术干预是不可逆的。
乳腺癌高危女性群体由2个亚组组成:已知有基因突变的女性和没有高危突变的女性。前一类人的高危状态往往在更早的时候就被发现,终身风险估计往往比后一组高得多。在监测一段时间后, 在适当的年龄进行手术降低风险往往是高危基因突变携带者的首选干预措施。然而,这段监测期提供了一个讨论和实施药物预防性治疗的机会。年轻的BRCA1突变携带者预防性使用SERMs仍存在顾虑,然而,这种顾虑不应妨碍对其他突变携带者进行个性化预防。
预防性双侧乳腺切除术(BRRM)对没有突变的高危女性的益处尚未得到证实,对侧降低风险的乳房切除术(CRRM)也未被证实能为这些高危女性带来风险降低或生存的益处。许多这样的女性在40多岁时被归入高危类别,可能接近绝经年龄,这就增加了预防性治疗的选择,包括在绝经后不久开始进行更有效的AIs预防性治疗;也可以根据对副作用的耐受性/个人偏好来选择预防措施。因此, 对于没有已知基因突变的高危女性,药物性预防可以作为预防性干预的首选。
参考文献:
Best Pract Res Clin Obstet Gynaecol. 2020; 65:18-31.京东健康互联网医院医学中心
作者:卢秀玲,毕业自北京大学公共卫生学院,曾在某知名医学网站担任医学总编辑,负责过肿瘤、心血管、内分泌等多个频道的内容产出。
展开更多
展开更多
















