当前位置:首页>
未感染新冠的肿瘤患者的化疗推荐
ASCO 针对 COVID-19 大流行活跃期化疗提出的考虑事项包括:
1、对于接受维持治疗的深度缓解期患者,可选择停止化疗。
2、对于预计辅助化疗获益较小且可采用非免疫抑制治疗 (如,激素受体阳性早期乳腺癌或前列腺癌的激素治疗) 的患者,考虑到 COVID-19 的风险,可以省去化疗。也可改变化疗计划以减少就诊次数,或安排在受影响较小的医疗机构输液。
3、一般不提供静脉化疗的在家给药 (通常经输液泵给予的药物除外);然而,在某些情况下,只要能够与肿瘤团队协调以确保患者正确给药,就可以采取这种方法。

本站内容仅供医学知识科普使用,任何关于疾病、用药建议都不能替代执业医师当面诊断,请谨慎参阅
-
总交流次数
3
医生回复次数
2
患者:女 58岁
-
总交流次数
40
医生回复次数
21
患者:男 45岁
-
总交流次数
13
医生回复次数
7
患者:女
-
由于COVID-19疫苗目前体现出了较高的安全和有效性,因此,包括美国CDC在内的全球相关机构近期放宽了在正常情况下对于已接种疫苗个体的隔离及防护建议。然而,基于大多数疫苗试验会将免疫功能低下的人(占成年人比例约5%)排除在外,疫苗对于该类人群的疗效尚未可知,包括加强剂量的必要性、疫苗接种后抗体检测的效用以及长期保持社交距离及戴口罩的实用性等问题。
迄今为止,许多疫苗研究包括评估一剂或两剂疫苗(主要基于mRNA)后抗SARS-CoV-2刺突蛋白抗体反应的队列研究,使用了各种血清学检测,并且通常会将反应与具有免疫能力的人(通常经历近100%的血清转化)的反应进行比较。
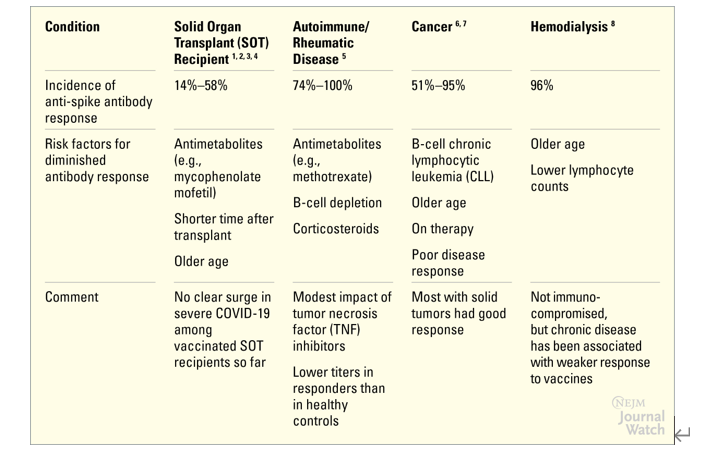
图表1:关于免疫功能低下患者的抗尖峰抗体反应的评审研究总结
一个数据前提是,我们还并不知道刺突蛋白抗体反应的临床意义。事实上,FDA最近给出建议,认为不应该检查疫苗接种后的抗体水平,因为阳性滴度可能无法完全反映保护,而阴性滴度则可能无法表明易感性。相比之下,T细胞反应(在血清学检测中不直接测量)能够提供一定程度的保护,尤其是针对严重疾病。
尽管如此,一些临床上的教训正在出现。数据显示,使用损害B细胞功能的免疫抑制剂(如霉酚酸酯、利妥昔单抗)与疫苗抗体反应不佳有关,年龄较大也是如此。即使是低剂量皮质类固醇也可能损害血清学反应。癌症患者如果在停止治疗时接种疫苗,其血清转换的可能性会增加。不过B细胞慢性淋巴细胞白血病患者可能是一个例外。
鉴于许多疫苗的功效都被证明会在免疫功能低下的患者中减弱,COVID-19疫苗可能也是如此的原理。那么,第三剂是否是有益的?
在一项第三剂疫苗在实体器官移植受者中的安全性和免疫原性研究性试验中,研究人员描述了30名实体器官移植受者的疫苗增强结果。在初始疫苗接种期间,30名患者中有57%接受了2剂162b2 疫苗(Pfizer/BioNTech),43%接受了2剂mRNA-1273疫苗(Moderna)。这些受者在接种两剂mRNA疫苗后,抗体反应很低或没有可测量的反应。随后,一半接受了Ad26.COV2.S(强生)疫苗的加强,另一半接受了第三剂mRNA疫苗。在初始抗体反应低的6名患者中,100%在第三次给药后达到了高抗体效价;在对初始系列没有反应的24人中,只有25%在此之后发展出了高滴度。

图表2:接种第三剂疫苗后的自我报告反应
这是第一份关于接受第三剂针对SARS-CoV-2的疫苗的实体器官移植患者的报告。令人鼓舞的是,三分之一抗体滴度呈阴性的患者和所有抗体滴度呈低阳性的患者在第三次给药后抗体滴度增加。此外,考虑到这些疫苗可以带来的好处,疫苗反应似乎是可以接受的。然而,抗体反应似乎各不相同,潜在的风险,如器官排斥,应根据个人情况进行评估。
这些观察结果将在不久之后为临床提供援助,来确定是否可以将帮助器官移植等免疫抑制患者预防新冠的疫苗加强剂量纳入临床实践,就像乙型肝炎和流感疫苗接种一样。但在当下的临床阶段,应该如何为免疫功能低下的患者提供接种疫苗后的检测及建议,主要出于以下几个问题的考虑。
接种疫苗后是否应当检查常规刺突蛋白抗体滴度?
目前,科研结果的临床意义尚未得出结论,因此并不推荐常规滴度,因为它们可能会产生虚假的保护或虚假的脆弱性担忧,而一些市售检测不针对刺突蛋白,预计只有在自然感染后才会呈阳性。
免疫功能低下人群是否应该接受额外剂量的疫苗?
从科研试验来看,支持这种做法的安全性或有效性的数据非常有限,这超出了当前的紧急使用授权,但针对这一主题的研究正在进行中,或可期待下一步的数据建议。
接种疫苗的免疫功能低下患者是否应该遵循戴口罩和社交距离指南?
将疫苗接种和口罩、社交距离等掩蔽建议联系起来的新CDC指南,对于免疫功能低下的患者尤其具有挑战性,这会导致他们越来越多地接触选择不防护的未接种疫苗的个体,特别是在没有切实可行的方法来执行此建议的情况下。对于免疫功能低下的患者来说,虽然他们应该接种疫苗,但并不能以此来保证自己的安全,因此,他们应该继续戴口罩并保持社交距离。同时,医生鼓励免疫功能低下患者的密切接触者接种疫苗,也有助于降低新冠传播风险。
免疫功能低下人群应该如何处理疫苗接种的时间?
只要有可能,疫苗接种应在免疫抑制减弱的时候进行。例如,在化疗周期之间,实体器官移植之前等。其中,利妥昔单抗可能会造成问题出现(由于其对B细胞的强效作用),应尽可能在接近周期结束时接种疫苗。
此外,根据传染病医学博士的观察,在大多数情况下,不应该减少所需的免疫抑制以增加疫苗反应,特别是在移植受者中。然而,美国风湿病学会确实曾提出建议,对于那些疾病稳定的患者来说,在接种疫苗后1至2周内应进行一些免疫调节治疗(例如霉酚酸酯、甲氨蝶呤)。
针对上述几个问题所提供的合理指导是基于有限的数据及常识得出的。目前,几项试验计划中和正在进行的研究将有望为免疫功能低下患者所面临的疫苗接种问题提供更明确的答案。
参考文献:
1. Daniel K, et al. How Should We Advise Our Immunocompromised Patients After COVID-19 Vaccination. NEJM Journal Watch 2021 Jun 14.
2. Werbel WA, Boyarsky BJ, Ou MT, et al. Safety and Immunogenicity of a Third Dose of SARS-CoV-2 Vaccine in Solid Organ Transplant Recipients: A Case Series. Annals of Internal Medicine 2021 Jun 15.
3. Jackson LA , Anderson EJ , Rouphael NG , et al; mRNA-1273 Study Group. An mRNA vaccine against SARS-CoV-2—preliminary report. N Engl J Med. 2020;383:1920-31.
4. Boyarsky BJ et al. Immunogenicity of a single dose of SARS-CoV-2 messenger RNA vaccine in solid organ transplant recipients. JAMA 2021 May 4;325:1784.
5. Boyarsky BJ et al. Antibody response to 2-dose SARS-CoV-2 mRNA vaccine series in solid organ transplant recipients. JAMA 2021 Jun 1;325:2204.
6. Marinaki S et al. Immunogenicity of SARS-CoV-2 BNT162b2 vaccine in solid organ transplant recipients. Am J Transplant 2021 Apr 17.
京东健康互联网医院医学中心
内容不得侵犯第三方的合法知识产权,若产生相关纠纷,作者需自行承担。
刘雨洁,本科毕业于南开大学,纽约大学研究生在读,关注神经科学、生物制药、基因技术、细胞技术等领域的前沿技术成果。
-
免疫检查点抑制剂(lCls)现在被广泛用于多种肿瘤的治疗,最常见的是程序性细胞死亡蛋白1(PD-1)和细胞毒性T淋巴细胞抗原-4(CTLA-4)抑制剂。免疫治疗导致了细胞免疫能力的恢复,以识别和消灭癌细胞。然而,免疫系统平衡的这种变化可能导致免疫相关不良事件(irAEs),这些毒性是该类药物所特有的,一般来说是可控的,但偶尔也会造成重大副作用和死亡。
由于严格的临床试验招募标准,许多患者没办法纳入免疫检查点抑制剂最初的临床试验,这类患者主要包括: 自身免疫性疾病(AlD)、慢性病毒感染、器官移植、器官功能障碍、功能状态差、脑转移患者,以及老年人、儿童和孕妇。近日,肿瘤领域的知名期刊《肿瘤学年鉴》刊登了一篇文章,总结了 免疫检查点抑制剂在上述特殊人群中的疗效和安全性,因为这些人群在临床实践中占据很大比例。
自身免疫性疾病 (AID)
关于免疫检查点抑制剂在AlD人群中的疗效和安全性,在首个针对抗PD-1药物用于AlD患者的回顾性研究中,黑色素瘤患者的客观缓解率(ORR)为33%,AID发作率为38%(6%为3级),其他irAEs发生率与之前临床试验中的报告类似(总体发生率为29%,10%为3级)。随后针对PD-(L)1药物的回顾性研究(主要是黑色素瘤和非小细胞肺癌患者)报告了类似的结果:ORR,22%-54%;AID发作率,6%-42%;irAEs发生率,16%-38%。
迄今为止唯一的前瞻性研究(阿特朱单抗治疗泌尿系统肿瘤)发现,与非AlD患者(N=962)相比,AlD患者(N=35)的irAEs发生率增加(皮肤病、肝病、内分泌和呼吸系统事件以及AlD发作):46% vs 30%;≥3级事件的发生率为14% vs 6%。11%的患者出现AID发作,但可以控制,很少导致免疫治疗停药;ORR为11% vs 14%。
在一项对49篇文献的系统综述中(N=123,主要是黑色素瘤和NSCLC患者),50%的患者出现了AID发作,34%的患者出现了新的非相关性irAEs,其中大部分事件可以用皮质类固醇来控制,无需停用免疫治疗。免疫检查点抑制剂在AID和非AID人群中的临床疗效相似。
总结现有证据来看, 患者本身存在轻度至中度AID,未必要禁止免疫检查点抑制剂的使用,许多患者(约60-90%)没有AID发作或只是轻度发作,不需要停止免疫治疗,甚至不需要使用皮质类固醇。那些经历过irAEs事件或AID发作的患者,通常可以通过标准治疗成功地进行管理。
然而,还有很多问题有待解决,例如, 对中度至重度AID患者或特别是神经系统AID患者,免疫检查点抑制剂治疗的情况还知之甚少。此外,也有过病情严重恶化的报道。因此,需要对这类患者进行个性化的多学科管理。最近发表了一个基于风险的AID患者个体化管理策略,主要探讨的是启动免疫治疗之前使用节制激素用药的选择性免疫抑制剂。
HIV或HBV/HCV感染患者
在对HlV感染的癌症患者的研究中,发现免疫检查点抑制剂治疗产生了抗肿瘤活性,其安全性与非HIV人群中报告的相似,大多数irAEs为1/2级,没有证据表明免疫重建炎症综合征的发生风险会增加。大多数患者在免疫检查点抑制剂治疗过程中同时进行抗逆转录病毒治疗,对HlV病毒负荷或CD4+T细胞计数没有明显不利的影响。
关于免疫检查点抑制剂对HlV潜伏期的影响,各研究结果并不一致。目前正在有前瞻性研究调查ICl治疗的癌症患者中HIV感染的免疫学和病毒学特征。总的来说,现有的数据表明, HlV感染的患者不应排除在免疫检查点抑制剂方案之外,可以在不增加毒性或影响HlV控制的情况下取得良好的临床疗效。
同样,在对乙肝/丙肝患者的免疫检查点抑制剂研究中,免疫检查点抑制剂的临床活性和安全性看起来与非感染者相似,包括多种肿瘤类型。迄今为止最大的回顾性研究发现,HBV再激活/复发率为5.3%。一些患者在免疫检查点抑制剂治疗中HCV RNA有所减少。
免疫缺陷患者,包括移植受者
癌症患者可能同时存在免疫缺陷,例如,皮肤癌患者通常伴有慢性淋巴细胞白血病(CLL),在这些患者中,免疫检查点抑制剂的治疗经验有限。最近一项对不可切除皮肤癌合并血液恶性肿瘤(最常见的是CLL)患者的回顾性研究中,免疫检查点抑制剂治疗后,黑色素瘤的ORR为31.8%,梅克尔细胞癌为18.8%,皮肤鳞状细胞癌(SCC)为26.7%,其生存结局与真实世界中免疫功能正常人群中观察到的结果相似(SCC除外,其生存结局更差)。免疫检查点抑制剂也是CLL患者的一种新兴治疗策略,抗PD-1的早期试验提示对CLL患者有一定疗效,总体上毒性可接受。
免疫状态低下也可能是长期免疫抑制剂治疗的结果,如移植受者所接受的免疫抑制治疗。此外,考虑到CTLA-4和PD-1在诱导和维持异体移植耐受中的作用,使用免疫检查点抑制剂可能有打破耐受和增加移植排斥的风险。在异体造血干细胞移植(allo-HSCT)中,免疫检查点抑制剂可能会增强异体T细胞反应,增强移植物的抗肿瘤效果,但也可能增加移植物抗宿主疾病(GVHD)的发生风险。
实体器官移植受者使用免疫检查点抑制剂的经验主要来自对病例报告的分析,其中最大的是对83个病例(黑色素瘤、肝细胞癌、皮肤SCC)的系统综述,这些病例主要接受抗PD-(L)1治疗(73.5%)。结果显示, 异体移植排斥率为39.8%(肾脏43.4%,肝脏37.5%,心脏16.7%)。这导致71%的病例出现了终末期器官衰竭(肾脏72.7%,肝脏75.0%,心脏0%);ORR为27.7%。
与基于CTLA-4的方案相比,基于PD-(L)1方案的风险更高,但未达到统计学意义。在对64名免疫检查点抑制剂治疗的移植受体(主要是黑色素瘤、肝细胞癌、肺癌)进行的第二项大型系统综述中, 41%的患者出现了移植排斥反应。该人群的ORR为36%,治疗缓解者和非缓解者的移植排斥率相似(36% vs 35%)。
移植排斥的主要风险因素尚不清楚,有研究显示,使用除类固醇以外的≥1种免疫抑制剂、移植后时间较长(>8年)、既往没有排斥病史,移植排斥风险较低。目前还不清楚哪种免疫抑制剂治疗能充分降低排斥风险而又不明显降低免疫检查点抑制剂的活性。
由于透析是肾移植失败后的一种选择,在这种情况下,只要患者充分了解可能的肾衰竭风险和影响,使用免疫检查点抑制剂治疗是可行的。然而, 如果患者无法接受移植排斥和透析风险,就不应该使用抗PD-1药物。不幸的是,在肝脏或心脏异体移植失败的情况下,不存在其他备选方案,因此不建议对患者进行抗PD-1治疗。
参考文献:
Ann Oncol. 2021;32(7):866-880.
京东健康互联网医院医学中心
作者:毛息花,肯塔基大学公共卫生硕士。主要研究方向为癌症流行病学与慢性病流行病学。
-
免疫检查点抑制剂(lCls)现在被广泛用于多种肿瘤的治疗,最常见的是程序性细胞死亡蛋白1(PD-1)和细胞毒性T淋巴细胞抗原-4(CTLA-4)抑制剂。免疫治疗导致了细胞免疫能力的恢复,以识别和消灭癌细胞。然而,免疫系统平衡的这种变化可能导致免疫相关不良事件(irAEs),这些毒性是该类药物所特有的,一般来说是可控的,但偶尔也会造成重大副作用和死亡。
由于严格的临床试验招募标准,许多患者没办法纳入免疫检查点抑制剂最初的临床试验,这类患者主要包括: 自身免疫性疾病(AlD)、慢性病毒感染、器官移植、器官功能障碍、功能状态差、脑转移患者,以及老年人、儿童和孕妇。近日,肿瘤领域的知名期刊《肿瘤学年鉴》刊登了一篇文章,总结了 免疫检查点抑制剂在上述特殊人群中的疗效和安全性,因为这些人群在临床实践中占据很大比例。
自身免疫性疾病 (AID)
关于免疫检查点抑制剂在AlD人群中的疗效和安全性,在首个针对抗PD-1药物用于AlD患者的回顾性研究中,黑色素瘤患者的客观缓解率(ORR)为33%,AID发作率为38%(6%为3级),其他irAEs发生率与之前临床试验中的报告类似(总体发生率为29%,10%为3级)。随后针对PD-(L)1药物的回顾性研究(主要是黑色素瘤和非小细胞肺癌患者)报告了类似的结果:ORR,22%-54%;AID发作率,6%-42%;irAEs发生率,16%-38%。
迄今为止唯一的前瞻性研究(阿特朱单抗治疗泌尿系统肿瘤)发现,与非AlD患者(N=962)相比,AlD患者(N=35)的irAEs发生率增加(皮肤病、肝病、内分泌和呼吸系统事件以及AlD发作):46% vs 30%;≥3级事件的发生率为14% vs 6%。11%的患者出现AID发作,但可以控制,很少导致免疫治疗停药;ORR为11% vs 14%。
在一项对49篇文献的系统综述中(N=123,主要是黑色素瘤和NSCLC患者),50%的患者出现了AID发作,34%的患者出现了新的非相关性irAEs,其中大部分事件可以用皮质类固醇来控制,无需停用免疫治疗。免疫检查点抑制剂在AID和非AID人群中的临床疗效相似。
总结现有证据来看, 患者本身存在轻度至中度AID,未必要禁止免疫检查点抑制剂的使用,许多患者(约60-90%)没有AID发作或只是轻度发作,不需要停止免疫治疗,甚至不需要使用皮质类固醇。那些经历过irAEs事件或AID发作的患者,通常可以通过标准治疗成功地进行管理。
然而,还有很多问题有待解决,例如, 对中度至重度AID患者或特别是神经系统AID患者,免疫检查点抑制剂治疗的情况还知之甚少。此外,也有过病情严重恶化的报道。因此,需要对这类患者进行个性化的多学科管理。最近发表了一个基于风险的AID患者个体化管理策略,主要探讨的是启动免疫治疗之前使用节制激素用药的选择性免疫抑制剂。
HIV或HBV/HCV感染患者
在对HlV感染的癌症患者的研究中,发现免疫检查点抑制剂治疗产生了抗肿瘤活性,其安全性与非HIV人群中报告的相似,大多数irAEs为1/2级,没有证据表明免疫重建炎症综合征的发生风险会增加。大多数患者在免疫检查点抑制剂治疗过程中同时进行抗逆转录病毒治疗,对HlV病毒负荷或CD4+T细胞计数没有明显不利的影响。
关于免疫检查点抑制剂对HlV潜伏期的影响,各研究结果并不一致。目前正在有前瞻性研究调查ICl治疗的癌症患者中HIV感染的免疫学和病毒学特征。总的来说,现有的数据表明, HlV感染的患者不应排除在免疫检查点抑制剂方案之外,可以在不增加毒性或影响HlV控制的情况下取得良好的临床疗效。
同样,在对乙肝/丙肝患者的免疫检查点抑制剂研究中,免疫检查点抑制剂的临床活性和安全性看起来与非感染者相似,包括多种肿瘤类型。迄今为止最大的回顾性研究发现,HBV再激活/复发率为5.3%。一些患者在免疫检查点抑制剂治疗中HCV RNA有所减少。
免疫缺陷患者,包括移植受者
癌症患者可能同时存在免疫缺陷,例如,皮肤癌患者通常伴有慢性淋巴细胞白血病(CLL),在这些患者中,免疫检查点抑制剂的治疗经验有限。最近一项对不可切除皮肤癌合并血液恶性肿瘤(最常见的是CLL)患者的回顾性研究中,免疫检查点抑制剂治疗后,黑色素瘤的ORR为31.8%,梅克尔细胞癌为18.8%,皮肤鳞状细胞癌(SCC)为26.7%,其生存结局与真实世界中免疫功能正常人群中观察到的结果相似(SCC除外,其生存结局更差)。免疫检查点抑制剂也是CLL患者的一种新兴治疗策略,抗PD-1的早期试验提示对CLL患者有一定疗效,总体上毒性可接受。
免疫状态低下也可能是长期免疫抑制剂治疗的结果,如移植受者所接受的免疫抑制治疗。此外,考虑到CTLA-4和PD-1在诱导和维持异体移植耐受中的作用,使用免疫检查点抑制剂可能有打破耐受和增加移植排斥的风险。在异体造血干细胞移植(allo-HSCT)中,免疫检查点抑制剂可能会增强异体T细胞反应,增强移植物的抗肿瘤效果,但也可能增加移植物抗宿主疾病(GVHD)的发生风险。
实体器官移植受者使用免疫检查点抑制剂的经验主要来自对病例报告的分析,其中最大的是对83个病例(黑色素瘤、肝细胞癌、皮肤SCC)的系统综述,这些病例主要接受抗PD-(L)1治疗(73.5%)。结果显示, 异体移植排斥率为39.8%(肾脏43.4%,肝脏37.5%,心脏16.7%)。这导致71%的病例出现了终末期器官衰竭(肾脏72.7%,肝脏75.0%,心脏0%);ORR为27.7%。
与基于CTLA-4的方案相比,基于PD-(L)1方案的风险更高,但未达到统计学意义。在对64名免疫检查点抑制剂治疗的移植受体(主要是黑色素瘤、肝细胞癌、肺癌)进行的第二项大型系统综述中, 41%的患者出现了移植排斥反应。该人群的ORR为36%,治疗缓解者和非缓解者的移植排斥率相似(36% vs 35%)。
移植排斥的主要风险因素尚不清楚,有研究显示,使用除类固醇以外的≥1种免疫抑制剂、移植后时间较长(>8年)、既往没有排斥病史,移植排斥风险较低。目前还不清楚哪种免疫抑制剂治疗能充分降低排斥风险而又不明显降低免疫检查点抑制剂的活性。
由于透析是肾移植失败后的一种选择,在这种情况下,只要患者充分了解可能的肾衰竭风险和影响,使用免疫检查点抑制剂治疗是可行的。然而, 如果患者无法接受移植排斥和透析风险,就不应该使用抗PD-1药物。不幸的是,在肝脏或心脏异体移植失败的情况下,不存在其他备选方案,因此不建议对患者进行抗PD-1治疗。
-
由于COVID-19疫苗目前体现出了较高的安全和有效性,因此,包括美国CDC在内的全球相关机构近期放宽了在正常情况下对于已接种疫苗个体的隔离及防护建议。然而,基于大多数疫苗试验会将免疫功能低下的人(占成年人比例约5%)排除在外,疫苗对于该类人群的疗效尚未可知,包括加强剂量的必要性、疫苗接种后抗体检测的效用以及长期保持社交距离及戴口罩的实用性等问题。
迄今为止,许多疫苗研究包括评估一剂或两剂疫苗(主要基于mRNA)后抗SARS-CoV-2刺突蛋白抗体反应的队列研究,使用了各种血清学检测,并且通常会将反应与具有免疫能力的人(通常经历近100%的血清转化)的反应进行比较。
图表1:关于免疫功能低下患者的抗尖峰抗体反应的评审研究总结
一个数据前提是,我们还并不知道刺突蛋白抗体反应的临床意义。事实上,FDA最近给出建议,认为不应该检查疫苗接种后的抗体水平,因为阳性滴度可能无法完全反映保护,而阴性滴度则可能无法表明易感性。相比之下,T细胞反应(在血清学检测中不直接测量)能够提供一定程度的保护,尤其是针对严重疾病。
尽管如此,一些临床上的教训正在出现。数据显示,使用损害B细胞功能的免疫抑制剂(如霉酚酸酯、利妥昔单抗)与疫苗抗体反应不佳有关,年龄较大也是如此。即使是低剂量皮质类固醇也可能损害血清学反应。癌症患者如果在停止治疗时接种疫苗,其血清转换的可能性会增加。不过B细胞慢性淋巴细胞白血病患者可能是一个例外。
鉴于许多疫苗的功效都被证明会在免疫功能低下的患者中减弱,COVID-19疫苗可能也是如此的原理。那么,第三剂是否是有益的?
在一项第三剂疫苗在实体器官移植受者中的安全性和免疫原性研究性试验中,研究人员描述了30名实体器官移植受者的疫苗增强结果。在初始疫苗接种期间,30名患者中有57%接受了2剂162b2 疫苗(Pfizer/BioNTech),43%接受了2剂mRNA-1273疫苗(Moderna)。这些受者在接种两剂mRNA疫苗后,抗体反应很低或没有可测量的反应。随后,一半接受了Ad26.COV2.S(强生)疫苗的加强,另一半接受了第三剂mRNA疫苗。在初始抗体反应低的6名患者中,100%在第三次给药后达到了高抗体效价;在对初始系列没有反应的24人中,只有25%在此之后发展出了高滴度。
图表2:接种第三剂疫苗后的自我报告反应
这是第一份关于接受第三剂针对SARS-CoV-2的疫苗的实体器官移植患者的报告。令人鼓舞的是,三分之一抗体滴度呈阴性的患者和所有抗体滴度呈低阳性的患者在第三次给药后抗体滴度增加。此外,考虑到这些疫苗可以带来的好处,疫苗反应似乎是可以接受的。然而,抗体反应似乎各不相同,潜在的风险,如器官排斥,应根据个人情况进行评估。
这些观察结果将在不久之后为临床提供援助,来确定是否可以将帮助器官移植等免疫抑制患者预防新冠的疫苗加强剂量纳入临床实践,就像乙型肝炎和流感疫苗接种一样。但在当下的临床阶段,应该如何为免疫功能低下的患者提供接种疫苗后的检测及建议,主要出于以下几个问题的考虑。
接种疫苗后是否应当检查常规刺突蛋白抗体滴度?
目前,科研结果的临床意义尚未得出结论,因此并不推荐常规滴度,因为它们可能会产生虚假的保护或虚假的脆弱性担忧,而一些市售检测不针对刺突蛋白,预计只有在自然感染后才会呈阳性。
免疫功能低下人群是否应该接受额外剂量的疫苗?
从科研试验来看,支持这种做法的安全性或有效性的数据非常有限,这超出了当前的紧急使用授权,但针对这一主题的研究正在进行中,或可期待下一步的数据建议。
接种疫苗的免疫功能低下患者是否应该遵循戴口罩和社交距离指南?
将疫苗接种和口罩、社交距离等掩蔽建议联系起来的新CDC指南,对于免疫功能低下的患者尤其具有挑战性,这会导致他们越来越多地接触选择不防护的未接种疫苗的个体,特别是在没有切实可行的方法来执行此建议的情况下。对于免疫功能低下的患者来说,虽然他们应该接种疫苗,但并不能以此来保证自己的安全,因此,他们应该继续戴口罩并保持社交距离。同时,医生鼓励免疫功能低下患者的密切接触者接种疫苗,也有助于降低新冠传播风险。
免疫功能低下人群应该如何处理疫苗接种的时间?
只要有可能,疫苗接种应在免疫抑制减弱的时候进行。例如,在化疗周期之间,实体器官移植之前等。其中,利妥昔单抗可能会造成问题出现(由于其对B细胞的强效作用),应尽可能在接近周期结束时接种疫苗。
此外,根据传染病医学博士的观察,在大多数情况下,不应该减少所需的免疫抑制以增加疫苗反应,特别是在移植受者中。然而,美国风湿病学会确实曾提出建议,对于那些疾病稳定的患者来说,在接种疫苗后1至2周内应进行一些免疫调节治疗(例如霉酚酸酯、甲氨蝶呤)。
针对上述几个问题所提供的合理指导是基于有限的数据及常识得出的。目前,几项试验计划中和正在进行的研究将有望为免疫功能低下患者所面临的疫苗接种问题提供更明确的答案。
参考文献:
1. Daniel K, et al. How Should We Advise Our Immunocompromised Patients After COVID-19 Vaccination. NEJM Journal Watch 2021 Jun 14.
2. Werbel WA, Boyarsky BJ, Ou MT, et al. Safety and Immunogenicity of a Third Dose of SARS-CoV-2 Vaccine in Solid Organ Transplant Recipients: A Case Series. Annals of Internal Medicine 2021 Jun 15.
3. Jackson LA , Anderson EJ , Rouphael NG , et al; mRNA-1273 Study Group. An mRNA vaccine against SARS-CoV-2—preliminary report. N Engl J Med. 2020;383:1920-31.
4. Boyarsky BJ et al. Immunogenicity of a single dose of SARS-CoV-2 messenger RNA vaccine in solid organ transplant recipients. JAMA 2021 May 4; 325:1784.
5. Boyarsky BJ et al. Antibody response to 2-dose SARS-CoV-2 mRNA vaccine series in solid organ transplant recipients. JAMA 2021 Jun 1; 325:2204.
6. Marinaki S et al. Immunogenicity of SARS-CoV-2 BNT162b2 vaccine in solid organ transplant recipients. Am J Transplant 2021 Apr 17. -
随着疫情的有效控制和好转,普通手术正在逐渐恢复,但仍需严格按照相关管理规范进行疫情对策。手术室外麻醉服务面广,涉及到多个领域内。医院内部员工交叉性传染和医生护士暴露在高危人群中的风险因此,在新冠肺炎期间内,必须满足病人对舒适医疗的需求,避免医院内部员工交叉性传染和医生护士交叉感染,对手术室外无痛诊疗技术谈到了新的问题。

无痛诊疗病人的评述和注意事项:除了完成所有病人的预检分诊外,麻醉科医生还需要评述病人的全身状况、合并症、器官功能状态等,重点评述困难的气道、逆流误吸的风险,对高龄、严重合并症病人进行相应的检查。按照评述的结论,选用相应的麻醉设计方案,签署协议麻醉知情同意书,记录病人详细信息,便于后期追踪和调查。接受无痛诊疗的病人需要在麻醉前禁食6小时,禁止饮用2小时。
而对于胃排空无异常的病人,建议大家麻醉前2h摄入足够含量饮用碳水化合物。而对于无痛胃肠镜诊疗的病人,胃肠道准备请参考消化内镜手术指南。无痛诊疗术麻醉相对禁忌证主要包括ASAV级以上、重要器官功能障碍(如最近心肌梗塞或脑梗塞)、严重心脏传导阻滞、恶性心律失常、重要器官功能失去代价、哮喘持续状态、严重肺部感染或上呼吸道感染等。
新冠肺炎盛行期间内,门诊无痛诊疗的麻醉设计方案正常来说以保留病人自主呼吸的静脉全身麻醉作为主科。手术时间长,有逆流误吸风险,影响气体交换的手术,以气管插管全身麻醉作为主料。疑似或确诊的病例均采用全身麻醉或监护麻醉设计方案。
门诊手术麻醉应选用效果快、消除快、镇痛效果好、对心肺功能影响小的口服药。新冠肺炎盛行期间内,应尽量选用不诱发咳嗽反应或咳嗽反应不明显、自主呼吸抑制轻的口服药。
新冠肺炎疫情的大爆发发挥了医院疫情防控的关键,也使得了手术室外麻醉运作的精细化管理。我们现在采用的交叉感染控制方法和制度可以满足过去的需求,但新冠肺炎盛行期间内不足,需要积累经验、改善和完善。麻醉医生护士在日常工作中,要严格执行标准预防措施,有效避免新冠肺炎盛行在医院内部员工传播和扩散。
-
首次化疗后注意事项包括饮食调节、生活调节、管理副作用
1.饮食调节:化疗可能对食欲和消化系统造成影响,平时要保持良好的饮食习惯,尽量选择易消化的食物,增加高蛋白、纤维素、矿物质等食物的摄入,比如鸡蛋、牛肉、牛奶、菠菜、芹菜等食物,避免食用过多刺激性食物和饮料。
2.生活调节:化疗可能导致疲劳和体力下降,平时要有足够的休息和睡眠,适当的活动,避免过度劳累。化疗后要注意个人卫生,勤洗手、勤更换衣服,保持清洁以减少感染风险。
3.管理副作用:化疗可能引发一些副作用,比如恶心、呕吐、脱发、口腔溃疡等,比如恶心和呕吐比较严重,可遵医嘱用甲氧氯普胺、托烷司琼等药物改善。
首次化疗后的注意事项比较多,伴随有其他不适要及时的就医,以上药物遵医嘱服用。
-
ep 方案化疗指的是联合使用顺铂和依托泊苷两种药物。
ep 方案在临床上常用于小细胞肺癌的化学治疗,主要包括顺铂和依托泊苷两种化疗药物。其中顺铂每个疗程用量为每天 20mg/平方米,而依托泊苷每个疗程用量为每天 80mg/平方米,通常分为 1-5 天用药,三周为一个疗程。
ep 方案在临床上使用广泛,但化学性治疗对人体同样会造成损害,因为在化疗前患者需在专业医师的指导下进行血常规、肝肾功能等相关检查,全面评估病情后再进行化疗方案的确定。
-
乳腺癌是一种常见的恶性肿瘤,早期通过化疗、对症治疗以及营养支持等方式可以缓解病情。然而,当乳腺癌转移到骨头时,往往提示着肿瘤已经进入晚期阶段。
针对乳腺癌骨转移的治疗,主要采取以下几种方法:
1. 化疗:通过静脉输液的方式,杀灭肿瘤细胞,减缓病情发展。
2. 对症治疗:针对患者出现的疼痛症状,可以通过肌肉注射止疼针等方式进行治疗。如果患者出现骨质破坏,可以应用药物抑制骨破坏,缓解疼痛。
3. 营养支持治疗:针对患者进食差的情况,可以通过营养支持治疗,提高患者的生活质量。
4. 内分泌治疗:通过调整患者体内的激素水平,抑制肿瘤生长。
5. 靶向治疗:通过针对肿瘤细胞特异性靶点的药物,抑制肿瘤生长。
乳腺癌的病因复杂,主要包括遗传、环境、饮食、激素等因素。家族史、高脂肪饮食、雌激素水平升高等都是乳腺癌的高危因素。
为了预防乳腺癌,女性应注意以下几点:
1. 建立健康的生活方式,保持良好的心态。
2. 注意饮食均衡,多吃新鲜蔬菜和水果。
3. 避免长期熬夜,保持良好的作息。
4. 定期进行乳腺检查,早期发现病情。
5. 及时治疗乳腺疾病,降低乳腺癌风险。
-
原发性甲状腺恶性淋巴瘤(PTML)是一种较为罕见的甲状腺恶性肿瘤,其治疗方式一直备受争议。早期,许多医生主张通过手术切除甲状腺进行治疗。但随着对恶性淋巴瘤认识的深入,以及放疗和化疗的不断发展,手术切除在PTML治疗中的应用逐渐减少,甚至仅作为活检的手段。放疗和化疗因其对淋巴瘤的高度敏感性而成为治疗的重要手段。
目前,关于PTML的治疗,普遍认为以下方案较为合理:
1. 对于早期PTML患者,建议进行甲状腺切除或加颈淋巴清扫手术,术后辅以放疗或化疗。
2. 对于晚期PTML患者,建议采取放疗联合化疗方案。当甲状腺肿块明显增大,出现压迫症状时,可考虑手术姑息切除,解除压迫。
3. 对于FNAC无法确诊的患者,可进行手术切除。术后根据分期,辅以放疗或联合放疗、化疗。
4. 放疗剂量一般为30~50Gy,主要针对区域淋巴结区和纵隔区。
5. 化疗方案一般选用CHOP(环磷酰胺、多柔比星、长春新碱和泼尼松)加上博来霉素、甲氨蝶呤或多柔比星(阿霉素)方案,平均周期为6个疗程。
6. 治疗后常见并发症包括放射性食管炎、皮肤红疹等,后期可能发生心肌炎、限制性心包炎等。化疗可能引起骨髓抑制,病毒性肺炎(博来霉素)等。
PTML的预后与肿瘤的生物行为状态、治疗方案和纵隔受累程度有关。中度恶性、低度恶性的PTML或合并HT者预后较好。Ⅲ、Ⅳ期,纵隔有转移者预后较差。治疗后复发率较高,死因多为恶性淋巴瘤进展性急变以及腹腔实质脏器转移。
-
化疗,作为肿瘤治疗的重要手段之一,常常让患者和家属产生疑问:化疗需要住院吗?本文将为您解答这个问题,并为您提供化疗期间的注意事项。
一、化疗是否需要住院?
化疗是否需要住院,主要取决于化疗的药物种类、剂量以及患者的病情。一般来说,以下情况需要住院:
1. 使用需要静脉注射的化疗药物,如紫杉醇、阿霉素等。
2. 使用剂量较大的化疗药物,如大剂量顺铂、大剂量环磷酰胺等。
3. 患者病情较重,需要密切观察病情变化。
4. 患者存在化疗禁忌症,如肝肾功能不全、严重感染等。
二、化疗期间注意事项
1. 保持良好的心态:化疗期间,患者可能会出现焦虑、抑郁等情绪,此时保持良好的心态非常重要。
2. 保持营养均衡:化疗期间,患者的食欲可能会下降,但保持营养均衡对恢复至关重要。
3. 注意个人卫生:化疗期间,患者免疫力下降,容易感染,因此要注意个人卫生。
4. 定期复查:化疗期间,患者需要定期复查,以便及时了解病情变化。
三、化疗不良反应及应对措施
1. 消化道反应:化疗药物可能会引起恶心、呕吐、口腔溃疡等消化道反应,此时可以通过以下措施缓解:
(1)保持良好的饮食习惯,避免辛辣、油腻食物。
(2)使用止吐药物。
2. 恶性肿瘤细胞溶解综合征:化疗药物可能会引起恶性肿瘤细胞溶解综合征,表现为高钾血症、高尿酸血症等,此时需要及时进行对症处理。
四、化疗药物的选择
化疗药物的选择应根据患者的具体病情、年龄、性别、身体状况等因素综合考虑。以下是一些常见的化疗药物:
1. 紫杉醇:适用于乳腺癌、卵巢癌、肺癌等。
2. 阿霉素:适用于乳腺癌、卵巢癌、肺癌等。
3. 紫杉醇+卡铂:适用于卵巢癌。
4. 顺铂+长春新碱:适用于肺癌。
五、化疗后的恢复
化疗结束后,患者需要进行一段时间的恢复。以下是一些建议:
1. 保持良好的生活习惯,避免过度劳累。
2. 定期复查,了解病情变化。
3. 保持乐观的心态,积极配合医生的治疗。
-
朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)是一种罕见的疾病,其治疗方法取决于患者的具体情况和病情严重程度。本文将探讨LCH的治疗方法,包括手术、放疗、化疗和抗生素治疗。
一、手术与放疗
对于单个系统受影响的LCH患者,手术和放疗可能是有效的治疗方法。手术可以用于切除病变组织,而放疗可以用于缩小肿瘤或控制病情。
二、化疗
化疗是一种使用药物来杀死癌细胞或阻止癌细胞生长的治疗方法。对于多系统受影响的LCH患者,化疗可能是首选治疗方法。
三、抗生素治疗
对于LCH患者,抗生素治疗可能用于控制感染或预防感染。此外,对于患有LCH的儿童,可能需要补充维生素D和钙剂,以预防佝偻病。
四、支持性治疗
LCH患者可能需要支持性治疗,如输血、营养支持和心理支持。此外,患者可能需要定期进行监测和评估,以确保治疗效果。
五、预后
LCH的预后取决于多种因素,包括患者的年龄、病情严重程度和治疗方案。大多数LCH患者预后良好,但需要长期监测和定期评估。
总之,LCH的治疗方法取决于患者的具体情况。患者应与医生密切合作,制定个性化的治疗方案。
-
肺癌是一种常见的恶性肿瘤,其发病率和死亡率在我国逐年上升。本文将针对肺癌的治疗方法进行详细介绍,旨在为广大患者及家属提供参考。
一、肺癌的治疗方法
1. 手术治疗:对于早期肺癌,手术切除是首选治疗方法。手术可以切除肿瘤组织,降低复发风险。
2. 放疗:放疗是利用高能量射线杀死癌细胞的一种治疗方法。适用于局部肿瘤或转移性肿瘤的治疗。
3. 化疗:化疗是利用化学药物杀死癌细胞的一种治疗方法。适用于晚期肺癌或无法手术的肺癌。
4. 靶向治疗:靶向治疗是利用靶向药物特异性作用于癌细胞的一种治疗方法。适用于特定类型的肺癌。
5. 免疫治疗:免疫治疗是利用免疫细胞或药物激活人体免疫系统,杀死癌细胞的一种治疗方法。适用于部分晚期肺癌。
二、肺癌的预防与日常保养
1. 戒烟限酒:吸烟是肺癌的主要诱因之一,戒烟限酒可以有效降低肺癌的发生率。
2. 饮食健康:保持饮食均衡,多吃新鲜蔬菜和水果,少吃油腻、辛辣、刺激性食物。
3. 适量运动:适量运动可以增强体质,提高免疫力,降低癌症的发生率。
4. 定期体检:定期进行体检,及时发现肺癌的早期症状。
三、肺癌治疗的选择与注意事项
1. 治疗选择:根据患者的病情、年龄、身体状况等因素,选择最合适的治疗方案。
2. 注意事项:患者在治疗过程中,要注意饮食、休息、保持良好的心态,积极配合医生的治疗。
-
白血病,这一可怕的血液系统疾病,可以侵袭任何年龄段的人群,从新生儿到耄耋老人。其发病年龄跨度之大,令人咋舌。在众多年龄段中,有两个年龄段的白血病发病率尤为突出。
首先,儿童白血病的高发年龄主要集中在2~5岁之间。在这个年龄段,急性淋巴细胞白血病(ALL)的发病率较高,约占儿童白血病的70%以上。
其次,成人白血病的发病高峰期一般在40岁以上。在这个年龄段,急性非淋巴细胞白血病(ANLL)较为常见。而慢性白血病,如慢性粒细胞白血病(CML)和慢性淋巴细胞白血病(CLL),则更倾向于在60岁以上的老年人中发生。
目前,治疗白血病的方法主要包括化疗、放疗、靶向治疗、免疫治疗和干细胞移植等。其中,化疗是最常用的治疗方法,通过使用化学药物来抑制或杀死白血病细胞。
除了治疗,白血病患者的日常保养也至关重要。患者应保持良好的饮食习惯,适当增加运动量,提高自身免疫力。同时,要避免接触有害物质,如苯、氮芥等化学物质,以及放射性物质。
在我国,白血病患者的预后取决于多种因素,包括病种、分期、治疗方案等。早期发现、早期治疗是提高患者生存率的关键。
总之,白血病是一种复杂的疾病,需要我们共同关注和努力。通过提高公众对白血病的认识,加强预防措施,我们可以为患者创造更好的治疗环境。
-
乳腺癌作为女性最常见的恶性肿瘤之一,其治疗方式一直是医学界关注的焦点。欧阳取长教授,作为湖南省肿瘤医院乳腺内科的权威专家,在2015年湖南省肿瘤医学论坛上发表了题为《乳腺癌内科治疗策略》的精彩演讲,为乳腺癌患者提供了宝贵的治疗建议。
在演讲中,欧阳教授详细介绍了乳腺癌辅助化疗的策略。他强调,对于辅助化疗,不建议减少化疗周期数或剂量。首次给药剂量应不低于推荐剂量的85%,后续给药剂量可根据患者的不良反应适当调整,但每个方案仅允许剂量下调2次。此外,辅助化疗一般不与内分泌治疗或放疗同时进行,化疗结束后再开始内分泌治疗,放疗与内分泌治疗可先后同时进行。
欧阳教授还特别强调了绝经概念在辅助内分泌治疗中的重要性。他指出,停经、闭经并不等同于绝经,40多岁的患者停经后不应立即使用绝经后患者的药物。绝经期的内分泌治疗期间应注意避孕,并定期进行妇科检查,监测子宫内膜厚度。对于高危复发风险的患者,建议加用卵巢去势。
在乳腺癌晚期化疗方面,欧阳教授指出应首选单药序贯化疗或联合化疗,常用的单药包括蒽环类、紫杉类、抗代谢药以及非紫杉类微管所形成抑制剂。他强调,在决定治疗方案前应对复发或转移部位进行活检,明确诊断并重新评估肿瘤的ER、PgR和HER2状态,并根据分子分型选择制定治疗方案。
欧阳取长教授的演讲为乳腺癌患者提供了科学的、实用的治疗建议,对于提高乳腺癌患者的生存率和生活质量具有重要意义。
-
近年来,我国鼻咽癌发病率持续上升,严重威胁着人们的健康。中山大学肿瘤防治中心的马骏、孙颖教授团队,经过多年研究,成功找到了一种提高鼻咽癌治疗效果的新方法,并在国际权威期刊《新英格兰医学杂志》发表。
该研究主要针对局部区域晚期鼻咽癌患者,通过在同期放化疗前增加吉西他滨+顺铂(GP方案)诱导化疗,将3年无瘤生存率从76.5%提高到85.3%,3年总生存率从90.3%提高到94.6%。同时,GP诱导化疗方案安全性高,超过95%的患者可以顺利完成3程诱导化疗。
这项研究标志着我国在鼻咽癌治疗领域取得了重大突破,为患者带来了新的希望。以下是对该研究的详细解读:
1. 鼻咽癌的发病原因及现状
鼻咽癌是一种发生在鼻咽部的恶性肿瘤,其发病原因尚不完全清楚,可能与遗传、环境、生活习惯等因素有关。据统计,我国鼻咽癌发病率居世界之首,是全球范围内最常见的恶性肿瘤之一。
2. 鼻咽癌的治疗方法
目前,鼻咽癌的治疗方法主要包括手术、放疗、化疗等。其中,放疗和化疗是治疗局部区域晚期鼻咽癌的主要手段。
3. GP诱导化疗方案的优势
GP诱导化疗方案是一种新型化疗方案,具有以下优势:
(1)疗效显著:GP诱导化疗方案可以显著提高局部区域晚期鼻咽癌患者的生存率。
(2)安全性高:GP诱导化疗方案安全性高,副作用较小。
(3)耐受性好:GP诱导化疗方案患者耐受性好,易于接受。
4. GP诱导化疗方案的应用前景
GP诱导化疗方案有望成为局部区域晚期鼻咽癌的标准治疗方案之一,为患者带来更多希望。
-
电影《滚蛋吧,肿瘤君!》中,梁医生那句‘我负责治病,你负责相信我’不仅令人印象深刻,也引发了对医患关系的思考。癌症患者需要相信医生,积极配合治疗,才能战胜病魔。
现实生活中,有一位名叫老刘的医务工作者,也是一位晚期胃癌患者。他坚定地相信医生,积极配合治疗,从原本只能存活2个月,奇迹般地活过了50多个月且病情稳定。他的经历告诉我们,相信医生、积极配合治疗,是战胜病魔的关键。
老刘在得知自己患癌后,虽然十分恐慌,但他很快从“惊吓”中回过神来,坦然面对疾病。他相信医生,积极配合治疗,从胃癌根治术、化疗到靶向药物阿帕替尼,他都积极配合,最终病情得到了稳定。
老刘的经历告诉我们,癌症患者要相信医生,积极配合治疗,同时也要保持乐观的心态,积极面对生活。只有这样,才能战胜病魔,回归健康的生活。
此外,预防癌症也是非常重要的。我们要养成良好的生活习惯,保持健康的饮食,定期体检,以便及时发现和治疗癌症。
-
乳腺癌是女性常见的恶性肿瘤之一,乳腺癌的治愈率取决于发现时间、治疗方法以及患者的身体状况。本文将介绍乳腺癌的早期症状、治疗方法以及如何预防乳腺癌。
乳腺癌的早期症状包括乳房肿块、乳头溢液、乳房皮肤改变等。一旦发现这些症状,应及时就医,进行进一步的检查。乳腺癌的治疗方法包括手术、放疗、化疗、内分泌治疗等。手术是治疗乳腺癌的主要方法,可以根据病情选择保乳手术或全乳切除术。放疗和化疗可以杀灭癌细胞,内分泌治疗可以抑制雌激素对乳腺癌细胞的刺激。
为了预防乳腺癌,女性应定期进行乳腺检查,保持健康的生活方式,如戒烟、限酒、保持体重、进行体育锻炼等。此外,乳腺癌家族史的女性应更加注意预防,可以在医生的建议下进行基因检测。
乳腺癌的治疗是一个复杂的过程,需要患者、医生和家属的共同努力。患者应保持乐观的心态,积极配合医生的治疗,同时也要关注自己的身体状况,及时反馈治疗效果。
放疗科是治疗乳腺癌的重要科室,放疗科医生具有丰富的临床经验和专业知识,可以为患者提供个性化的治疗方案。放疗科拥有先进的放疗设备,可以精确地杀灭癌细胞,减少对正常组织的损伤。
除了放疗科,乳腺癌的治疗还需要其他科室的协作,如乳腺外科、化疗科、内分泌科等。多学科综合治疗可以提高乳腺癌的治愈率,延长患者的生存时间。






