文章 警惕糖尿病患者的急性肾损伤风险增加
糖尿病患者的肾脏疾病概念已经发生了变化,传统的 "糖尿病肾病"概念,主要基于白蛋白尿的阶段性进展,导致肾小球滤过率下降和终末期肾病(ESKD),而如今对糖尿病肾病的复杂性和异质性有了更为细致的理解。在发生这种改变的同时,人们认识到急性肾损伤(AKI)的发病率正在迅速增加, 糖尿病患者比非糖尿病人群更容易发生AKI。有研究者提议, AKI应被视为糖尿病的一种并发症。基于此,从而可以开辟一条新的路径,来改善糖尿病和有肾脏疾病风险患者的诊疗。
糖尿病会增加AKI的发生风险
许多研究都得出以下结论: AKI在糖尿病患者中更为常见。一项针对449,524名接受冠状动脉旁路移植(CABG)或瓣膜手术患者的评估中,发现糖尿病患者术后需要肾脏透析的风险显著增加。SWEDEHEART注册研究中2003年至2013年间接受CABG手术的36106名患者中, 1型糖尿病患者比2型糖尿病患者更常发生AKI。一项纳入>100万参与者的荟萃分析显示,估计肾小球滤过率(eGFRs)降低和尿白蛋白-肌酐比(ACRs)升高与AKI风险增加有关,但不论何种水平的eGFR或ACR,糖尿病患者的AKI风险均增加。
糖尿病患者的AKI发生率不仅增加, 在发生AKI后,病情似乎也更为严重。一项研究显示,糖尿病患者的AKI需要透析的风险,比非糖尿病患者高约5倍。
最后,值得注意的是,糖尿病患者AKI风险的增加并不仅仅是衰老的原因,年龄对糖尿病AKI风险的影响并不像预期的那样简单。一项研究纳入了3471名糖尿病和社区获得性肺炎患者,观察到 ≥80岁患者的eGFR降低和AKI风险间的相关性比年轻人更为明显。另一项注册登记研究发现,合并症、干预措施和某些药物对某些年龄组糖尿病患者的AKI风险有影响,但对其他年龄组没有影响。
为什么糖尿病会增加AKI的风险?
高血糖危象
除了糖尿病的长期并发症外, 糖尿病的急性高血糖并发症(糖尿病酮症酸中毒[DKA]或高渗性高血糖状态[HHS]) 也可增加AKI的风险。在一项对94名因 "严重DKA"而进入重症监护室患者的回顾性研究中,47名患者(50%)在入院时就发生了AKI。在一项针对165名因DKA住院的1型糖尿病儿童的研究中,106人(64.2%)发生了AKI,其中两人需要血液透析。HHS患者中AKI的发生率还没有明确的定义,然而,HHS患者常出现脱水,这容易导致AKI。
降糖药物可能增加AKI风险,也可能降低AKI风险
有些糖尿病药物有可能增加AKI的发生风险,但药物对糖尿病患者AKI发病率增加的实际影响并不像预期的那样明确。支持RAAS阻断剂在AKI发生中起到主要作用的数据非常少。例如,一项队列研究中,纳入了570,445名参与者(303,761人使用ACEI或ARB),经过4.1年的随访,AKI的相对发生风险增加很小。然而, 双重肾素-血管紧张素系统阻断剂治疗确实会增加AKI风险,因此不推荐使用。
早期有人担心使用SGLT2抑制剂会增加AKI的风险,但目前得出的结论相反:SGLT2抑制似乎可减少AKI事件,三项独立的荟萃分析证实了AKI风险的降低。此外,在对两个队列人群的分析中,研究者发现 2型糖尿病患者服用SGLT2抑制剂,AKI的风险没有增加,而且有风险降低的趋势。即使在针对AKI高风险个体的随机对照试验中,也没有发现SGLT2抑制剂与AKI发生风险增加相关。
AKI是否会增加糖尿病患者的CKD风险?
AKI增加CKD和终末期肾病风险
近十年来产生的大量流行病学数据表明,AKI并不是一种良性、自限性和可逆转的疾病,AKI会增加慢性肾病(CKD)、终末期肾病(ESKD)和死亡风险,而且这种风险随着AKI的发作次数增加和AKI严重程度而增加。
2012年发表的一项系统综述和荟萃分析强调了AKI与长期肾功能恶化或ESKD的关联。该报告综合了13项队列研究的结果,得出结论:AKI患者与无AKI患者相比,CKD和ESKD的发生风险均显著增加。
近期对200多万参与者进行的一项荟萃分析报告了类似的关联;AKI患者的新发或进展性CKD的HR为2.67,ESKD的HR为4.81,死亡的HR为1.80。AKI和CKD风险的这种相关性在糖尿病患者中也很突出,例如,在3679名糖尿病患者中,经过10年的随访显示,发生过AKI与无AKI相比,4期CKD的HR为3.56,之后每发生一次AKI,4期CKD的风险就增加一倍。
AKI增加蛋白尿的发生风险
最近的前瞻性研究也表明, AKI是未来发生蛋白尿的一个风险因素。一项回顾性队列研究显示,在90614对有AKI和无AKI的匹配者中,有AKI与无AKI相比,尿液试纸检测阳性的OR为1.20-1.39。无论患者是否有潜在的糖尿病诊断,这种关联都存在。在对两个前瞻性队列的2048名参与者进行的多变量分析中,AKI与尿蛋白-肌酐比增加9%相关。
总结
随着对糖尿病长期风险的理解不断加深,对糖尿病及其并发症的理解也不断发展。AKI可认为是糖尿病的一种并发症,不是一种良性和可逆性的疾病,AKI会增加CKD、ESKD、主要不良心血管事件和全因死亡率的风险。
改善AKI患者预后的策略,应该集中在 早期识别患者,提供支持性措施,以及消除任何诱发因素,在AKI的早期预测方面也已经取得了进展。除了血糖控制、RAAS阻断以及最近的SGLT2抑制剂外,临床试验中大多数糖尿病肾病的治疗方法都未取得特别好的结果。这些试验成本高、耗时长,而且往往需要大量的患者来累积事件。鉴于AKI导致的糖尿病不良后果在不断增加,有理由认为针对这种急性并发症研发药物可能提供更好的获益。更好地了解糖尿病患者和实验模型中AKI的病理机制,可能为开发新的治疗方法开辟途径。与此同时,临床医生也应该对糖尿病患者AKI的风险和预后保持警惕。
参考文献:
Diabetes. 2020;69(11):2229-2237.
京东健康互联网医院医学中心
作者:杨超,毕业于北京大学医学部,现在北京大学第一医院工作,研究方向为慢性肾脏病流行病学研究。

医咖会
文章 Sirtuins在肾脏疾病中的作用
Sirtuins(SIRTs)全称为是Ⅲ蛋白型赖氨酸去乙酰化酶,共分为7种,大量已发表的研究表明其在细胞内稳态中发挥着重要作用。在肾脏疾病领域,Sirtuins通过调节氧化应激、凋亡、炎症、纤维化、细胞存活、ATP产生和线粒体生物发生,参与各种急慢性肾脏疾病(图),下文进行简要分析,以供临床参考。

图:Sirtuins在肾脏病中的作用(来源于文献)
Sirtuins在急性肾损伤中的作用
近年来,人们对Sirtuins在各种肾脏疾病的病理生理学中的作用越来越感兴趣。鉴于Sirtuins在肾小管中的表达及其对氧化应激、炎症和线粒体功能障碍的调节作用,表明其可能参与了急性肾损伤(AKI)的发病机制。
Sirtuins在缺血/再灌注诱导的肾损伤中的作用
衰老肾脏对缺血/再灌注(I/R)损伤的易感性增加了Sirtuins在I/R所致肾损伤发病机制中发挥作用的可能性。SIRT1过表达与I/R后对肾脏损伤的抵抗力增强有关,而一个SIRT1等位基因缺失则加重了I/R后的肾损伤。SIRT1可减轻I/R引起的肾损伤,同时激活抗氧化通路,如核因子红系相关因子2(Nrf2)/血红素加氧酶-1(HO-1)信号转导,可减少p53表达和细胞凋亡。SIRT1还可通过刺激线粒体生物发生减轻I/R所致的肾损伤。使用SIRT1激活剂SRT1720治疗可以通过减少线粒体质量、亚硝化应激和炎症来恢复肾脏ATP水平,从而减轻I/R引起的肾损伤。SIRT1激活剂促进线粒体生物发生和PGC-1α活化也被认为是I/R诱导的肾损伤后的修复机制。
I/R损伤可增加肾脏SIRT3的表达。鉴于SIRT3主要定位于线粒体基质,SIRT3可能影响I/R所致肾损伤的过程,这与线粒体功能障碍有关。SIRT3的过表达被发现通过抑制超氧化物的产生来提供肾脏保护。SIRT3的表达减少与I/R引起的肾损伤的严重程度相关,而SIRT3的恢复通过AMPK/PGC1α通路调节线粒体的动态平衡来逆转这种损伤。最近的一项研究报道,SIRT5在近端肾小管细胞的线粒体和过氧化物酶体中都有高表达,但与其他类型的Sirtuins相比,在I/R诱导的肾损伤中,SIRT5的表达趋势正好相反,因为SIRT5功能的丧失导致了I/R损伤后的肾脏保护作用,SIRT5控制下的脂肪酸氧化从线粒体转移到过氧化物酶体是其潜在的机制。相反,SIRT6的表达与缺氧诱导的肾小管上皮细胞损伤和炎症程度呈负相关。每种Sirtuin对I/R所致肾损伤的不同作用有待进一步研究阐明。
Sirtuins在顺铂致急性肾损伤中的作用
顺铂诱导的肾损伤使线粒体数量和功能降低,ROS生成增加。鉴于Sirtuins在线粒体生物发生和完整性中的核心作用,与其他AKI病因相比,Sirtuins在顺铂诱导的AKI中的作用得到了更广泛的研究。肾小管特异性sirt1转基因小鼠在顺铂治疗后肾损伤的功能和组织学指标减弱,这归因于顺铂诱导的氧化应激和凋亡减少。SIRT1的药理激活也与顺铂诱导的AKI通过NF-κB和p53信号通路调节氧化应激和炎症而减弱相关。
最近的研究强调了SIRT3在顺铂诱导的AKI中通过调节线粒体功能障碍而发挥的肾保护作用。小鼠SIRT3功能的丧失导致顺铂治疗后肾功能恶化的加重,而在野生小鼠中观察到的通过药理激活SIRT3可减弱顺铂诱导的肾损伤,在SIRT3缺陷小鼠中没有发生。
在肾小管细胞中,顺铂治疗后SIRT3表达减少导致线粒体碎片,而SIRT3表达激活逆转了损伤并保持了线粒体的完整性。SIRT3通过调节线粒体功能障碍在顺铂诱导的AKI中发挥肾保护作用,其他研究也进一步证实了这一作用。SIRT6基因敲除小鼠表现出加重顺铂所致肾损伤的作用,而SIRT6基因敲除小鼠通过去乙酰化H3K9和抑制细胞外信号调节激酶(ERK)-1/2的表达可减轻肾脏炎症和细胞凋亡。
与SIRT1、SIRT3和SIRT6相比,SIRT2和SIRT7的缺失(而非它们的过表达)通过调节p38和c-Jun n末端激酶(JNK)来减少炎症和凋亡,从而显著改善了顺铂诱导的AKI。关于SIRT5在顺铂诱导的AKI中的作用有不同的报道。在一项对肾小管细胞的研究中发现,SIRT5过表达通过调节Nrf2/HO-1和b细胞淋巴瘤2 (Bcl-2)来减轻顺铂诱导的细胞凋亡和线粒体损伤。然而,另一项研究报道,SIRT5功能缺失的小鼠通过过氧化物酶体脂肪酸氧化近端小管,显著改善了顺铂诱导的AKI的肾功能和小管损伤。SIRT5在顺铂诱导的AKI中的确切作用有待进一步阐明。
Sirtuins在其他类型急性肾损伤中的作用
大多数Sirtuins的免疫调节功能已被证明可以缓解脓毒症诱导的AKI。在盲肠结扎和穿刺动物模型中,SIRT1和SIRT6的过表达与脂多糖治疗引起的小管损伤的减轻有关。用Sirtuin激活剂白藜芦醇处理脓毒症诱导的AKI模型也获得了类似的结果。在脓毒症诱导的AKI中,Sirtuins的肾脏保护作用伴随着抑制炎症小体激活和促进自噬。然而,与顺铂诱导的AKI一致的是,脂多糖治疗后,SIRT2功能的丧失改善了小鼠的肾功能和肾小管损伤。
Sirtuins在造影剂肾病(CIN)中的作用也已经被证实。CIN是医院获得性AKI的第三大原因,据报道,与超氧化物产生相关的氧化应激及其相关通路参与了CIN的发病,并受Sirtuin表达水平的调节。之前研究表明白藜芦醇处理后SIRT1的激活,通过调节氧化应激和通过激活PGC-1α/FoxO1信号通路抑制CIN。另一项研究表明SIRT3缺失加重了CIN,而SIRT3- nrf2通路的激活则减轻了CIN。
Sirtuins在肾脏衰老中的作用
衰老是一个多因素的过程,其特征是生理功能的逐渐衰退。肾脏是年龄相关组织损伤的典型靶器官,老年人慢性肾病(CKD)发病率的增加是世界范围内一个新兴的健康问题。各种Sirtuins已经被证明可以减缓肾脏衰老。研究发现,衰老肾脏中SIRT1的表达降低,这一变化与其他靶分子如PGC-1α/雌激素相关受体-1α(ERR-1α)、PPARα、Klotho和HIF-1α的表达变化相关。最近,研究发现足细胞特异性降低SIRT1可加速衰老小鼠的肾脏损伤。因此,SIRT1被认为是治疗肾脏衰老的潜在靶点。
Sirtuins在糖尿病肾病中的应用
限制热量摄入不仅可以延缓衰老,增加寿命,还可以增加胰岛素敏感性。在一项临床研究中,在患有晚期糖尿病肾病(DN)的肥胖患者中,经过12周基于热量限制的强化减肥计划后,空腹血糖水平和胰岛素抵抗得到改善,并导致肾功能改善。糖尿病大鼠模型中的饮食限制增加了SIRT1在肾脏中的表达,改善了包括蛋白尿、肌酐清除和肾脏组织学在内的肾功能。因此,热量限制激活Sirtuins,这可能有助于防止DN的进展。
一些研究表明,SIRT1通过调节p53、AMPK/PGC-1α通路、Nrf2通路和FoxO降低线粒体氧化应激和凋亡,从而起到预防和改善DN的作用。SIRT1还通过系膜细胞中HIF-1α信号通路抑制高血糖条件下的肾炎症和纤维化。糖尿病小鼠足细胞特异性SIRT1缺失导致蛋白尿和足细胞损伤,这些改变与STAT3/NF-κB高乙酰化导致的肾脏炎症相关。此外,SIRT1通过下调高糖(HG)处理的足细胞和内皮细胞中血管内皮生长因子(VEGF)和Flk-1 (VEGFR-2)的表达来调节血管生成。
Sirtuins在慢性肾脏疾病中的作用
肾小管纤维化是CKD的主要病理改变,Sirtuins已被证实在肾小管纤维化中发挥重要作用。SIRT1敲除小鼠在单侧输尿管梗阻(UUO)模型中发现了明显的肾小管纤维化。抑制小鼠肾髓间质细胞中SIRT1的表达可导致细胞对氧化应激的抵抗能力显著降低。此外,SIRT1激活抑制5/6肾切除模型和UUO模型中的肾小管纤维化。SIRT1的表达也被发现参与了慢性肾移植功能障碍和慢性环孢素A (CsA)肾病的发病机制。在患有慢性同种异体移植肾功能障碍的大鼠肾脏中,SIRT1的减少与炎性细胞因子上调导致的单核细胞浸润和间质纤维化相关。在慢性CsA肾病小鼠模型中,SIRT1的表达通过Nrf2和PI3K/Akt/FoxO1通路根据小管间质纤维化程度而降低。
参考文献:Int. J. Mol. Sci. 2020, 21, 6686
京东健康互联网医院医学中心
作者简介:刘晓军,徐州医科大学硕士研究生,主修方向为肾病学,对急慢性肾损伤和风湿免疫相关疾病有较深入的研究,发表相关论文10余篇。

京东医生
文章 致命的体育锻炼
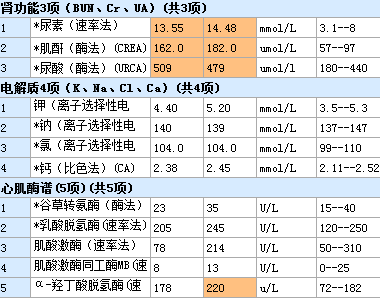
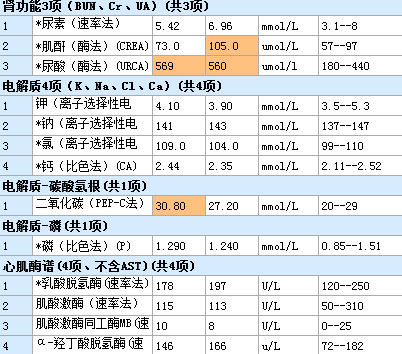
中考前夕我们接诊了一个年轻的病人,15岁,男性,因“蛙跳”20余分钟后出现全身肌肉酸痛,第二天开始出现酱油尿,尿量急剧减少,双下肢水肿,于第四天就诊于我院,询问病史过后,我们立马想到了横纹肌溶解所致的急性肾损伤,查心电图:
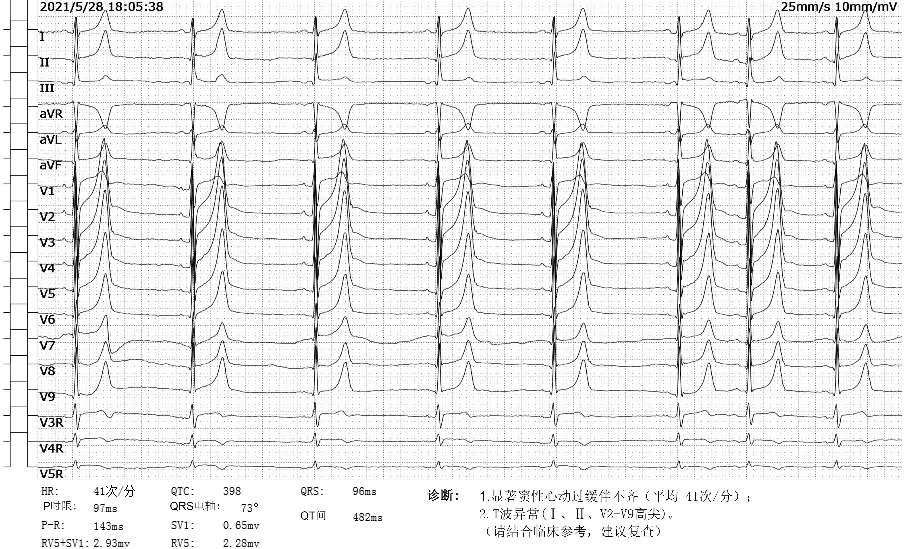
待检验报告出来,还好,没有高钾,诊断明确,横纹肌溶解症所导致的急性肾损伤。
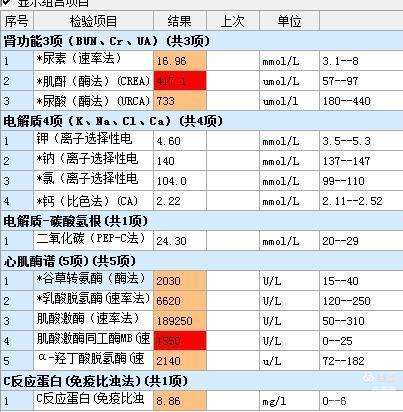
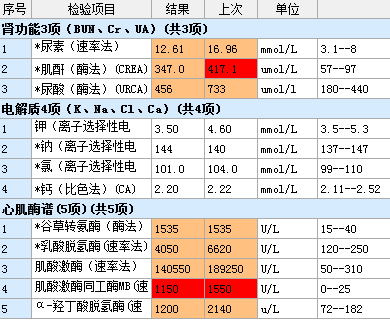
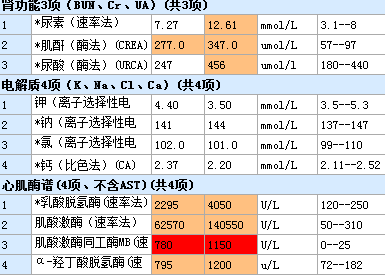


主治医师姜飒
文章 草酸和肾脏病的临床关系


副主任医师郜建新
文章 肾功能损害,要分清哪三种情况?

主任医师陆福明
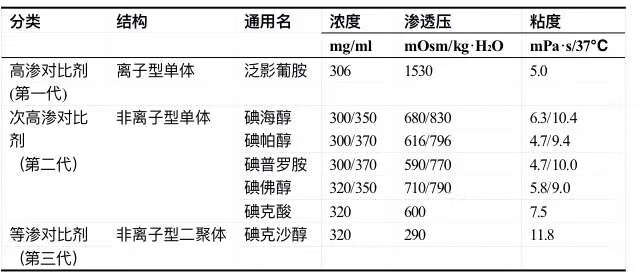
文章 三代碘对比剂,如何选择能减少肾损伤?不良反应如何处理?

主治医师冯小慧
文章 脓毒症相关急性肾损伤的治疗
脓毒症与50%的急性肾损伤(AKI)有关,而高达60%的脓毒症患者会发生AKI。目前病生理机制仍不完全清楚,脓毒症特有的有害炎症级联反应似乎是导致AKI的原因之一。相比没有AKI的患者,脓毒症并发AKI的患者死亡率显著增加;脓毒症相关AKI(SA-AKI)患者的死亡率也高于其他病因所致的AKI患者。下文将系统阐述SA-AKI的治疗方法。
液体复苏
脓毒症治疗的关键是给予静脉输液进行循环复苏。对于脓毒症患者, 高质量的液体复苏包括:初始给予适度量的复苏液(头三个小时内30 mL/kg),然后进行频繁评估,动态测量液体反应性,以确定是否需要更多液体或血管活性药物。过度复苏和复苏不足均与休克患者的不良结局有关。最近有研究表明,复苏并不能显著改善预后,但患者需要进行最低程度的复苏来降低不良结局的风险。
对于脓毒症患者,复苏液的类型至关重要。大量文献表明,复苏液的类型可能会影响脓毒症和SA-AKI的结局。羟乙基淀粉溶液是一种常用的高渗淀粉复苏液,但研究表明,在脓毒症和有AKI风险的患者中, 应该避免使用羟乙基淀粉溶液。多项研究表明,与多种晶体溶液相比,羟乙基淀粉溶液会增加脓毒症患者并发AKI的风险以及需要进行肾脏替代治疗(RRT)的风险。
其他研究人员在有AKI风险的脓毒症患者中比较了其他非高渗淀粉胶体溶液(如白蛋白)与晶体溶液的效果。研究结果表明,白蛋白虽然可适度改善血流动力学变量,但无法改善AKI和死亡率。因此,与价格较低的晶体溶液相比,不推荐使用白蛋白。
血管活性药物
对于SA-AKI患者,血管活性药物包括传统药物,如去甲肾上腺素、肾上腺素、加压素和多巴胺,还有越来越多的新药物,如血管紧张素II和左西孟旦。
去甲肾上腺素一直是脓毒症休克的主要治疗方法,可增加平均动脉压并改善肾脏灌注能力。在许多临床试验中,去甲肾上腺素通常是脓毒症休克的一线治疗药物,与其他血管活性药物相比,其治疗结局更好,不良事件更少。
一项血管加压素与脓毒症休克试验比较了血管加压素和去甲肾上腺素,结果显示在所有患者中两组结局相似,不良事件没有增加,在休克程度较轻的患者亚组分析中血管加压素有生存益处,提示 血管加压素可以是去甲肾上腺素的一线治疗替代药物。此外,在去甲肾上腺素短缺期间,苯肾上腺素和多巴胺是最常见的替代药物。结合其他试验数据,许多人建议避免使用苯肾上腺素,多使用多巴胺作为脓毒症休克的一线治疗。
血管紧张素II是肾素-血管紧张素-醛固酮系统中的一种激素,是最近在休克患者中研究的一种新型药物。一项名为ATHOS-3的试验显示,与安慰剂相比,血管紧张素II可使平均动脉压增加。如果经过大型队列研究的验证,血管紧张素II可能是SA-AKI的一种新疗法。
左西孟旦是一种钙致敏药物。一些小型研究表明,与多巴酚丁胺相比,左西孟旦可以增加肌酐清除率和尿液排出量。一项大型、双盲,随机试验在脓毒症成人患者中研究左西孟旦的效果,结果显示与安慰剂相比,肾脏结局并没有改善。 目前没有数据支持在SA-AKI患者中使用左西孟旦。
机械通气
脓毒症和脓毒症休克的重症患者通常需要进行 正压机械通气(PPV),以在器官衰竭的情况下提供氧气、通气和气道保护。正压机械通气对肾脏灌注和肾脏功能具有潜在的有害作用。机械通气还可能引起神经激素和炎症变化,从而可能增加AKI的风险。无论在任何剂量或压力下,机械通气均能持续产生一系列炎症,包括多种白介素、肿瘤坏死因子α和Fas配体,这些因素可能导致易发生AKI。
SA-AKI的药物治疗
在危重患者中,预防性使用利尿剂(特别是呋塞米)无法成功预防AKI,并且可能有害。利尿剂也无法改善或减轻AKI。因此, 不建议常规使用利尿剂预防或治疗SA-AKI。然而,鉴于利尿剂在调节和维持体液平衡方面的作用,在危重患者治疗中可继续使用利尿剂。
临床前和小型临床研究显示, 碱性磷酸酶系统性治疗对SA-AKI患者具有保护作用。碱性磷酸酶通过内毒素的直接脱磷酸作用起效,可以减轻炎症和器官功能障碍,提高存活率。一项国际性、随机、双盲、安慰剂对照IIa/IIb期研究纳入301位SA-AKI患者,随机接受不同剂量的碱性磷酸酶(0.4、0.8或1.6 mg/kg)和安慰剂,其中 1.6 mg/kg为最佳剂量。研究结果显示主要终点(第1至7天肌酐清除率的时间校正AUC)没有减少,但碱性磷酸酶组患者死亡率降低。鉴于1.6 mg/kg剂量组的28天死亡率降低,所以尽管重组碱性磷酸酶不是SA-AKI的治疗方法,但该药仍可能在脓毒症本身的治疗中起作用。
大量的临床前研究已经研究了可能预防或治疗SA-AKI的几种途径,主要集中于半胱氨酸蛋白酶和白介素抑制剂等分子,但迄今为止,尚未转化为SA-AKI的临床研究。
肾脏替代治疗
大量大型试验在SA-AKI患者中研究肾脏替代治疗(RRT),包括剂量、治疗时间和RRT的方式。在脓毒症和SA-AKI患者中关于RRT治疗时间的数据表明早期开始治疗有害。一项多中心随机对照试验表明, 脓毒症患者尽早开始RRT治疗可能没有益处。
在SA-AKI患者中对RRT剂量进行了广泛的研究,一些研究结果表明增加RRT剂量没有益处。两项大型研究和一些针对SA-AKI患者的小型研究表明, 高剂量RRT不能改善患者的生存率。
有限的数据表明某些特定的RRT方式有益处。一项随机对照研究纳入77位需要进行RRT的AKI患者,随机接受35 mL/kg/h连续性静脉-静脉血液滤过或连续性静脉-静脉血液透析,结果表明肾功能恢复和60天死亡率方面没有差异。没有数据支持在SA-AKI患者中连续性RRT优于间歇性血液透析,反之亦然。
参考文献:
BMJ. 2019; 364: k4891.
京东健康互联网医院医学中心
作者:杨超,毕业于北京大学医学部,现在北京大学第一医院工作,研究方向为慢性肾脏病和急性肾损伤。

医咖会
文章 关于急性肾损伤,您了解吗?

主治医师李强
文章 龟头有淤血,怎么办?

那天,我正坐在京东互联网医院的咨询窗口前,心里七上八下的。龟头上的那片淤血,就像一块沉重的石头压在我的心头。
医生,一个温文尔雅的中年男人,他的眼神里透着关切。他问我:“目前主要有哪些不适症状?”我摇摇头,说:“没有明显不适,就是发现那里有个结疤,掉下来后,就变成了淤血。”
医生的眼神变得严肃起来,他问:“最近有不洁性生活吗?”我回想了一下,说:“两个多月前有过。”
“您这个症状多久了?”医生追问。
“几个小时。”我回答。
医生又问:“您这个症状有线下检查或者用药吗?”我摇摇头:“线下泌尿外看了看,说是没事。”
医生沉默了一会儿,然后说:“根据您的描述,考虑龟头炎的可能性大。”
我紧张地问:“那怎么办?”
医生耐心地解释:“为用药安全,请您告诉我是否有药物过敏及肝肾损伤、慢性病史?是否有严重心血管病史?是否在备孕?”
我一一回答了他的问题,然后他又问:“您早上手淫过,是否有关?”我摇摇头。
医生说:“看起来像是皮下。是炎症导致的。”
我松了一口气,但紧接着又问:“那可以完全治愈吗?”
医生回答:“没有根治一说,类似感冒,一次感冒症状消失就是临床治愈,不代表永远不感冒。可以治疗的。”
我点了点头,心里多少有些释然。医生给我开了药,告诉我如何使用,并叮嘱我保持局部清洁干燥,避免摩擦刺激,避免辛辣刺激饮食,避免饮酒。
离开医院的时候,我心情复杂。我想起了那句老话:“健康没有小事。”我暗暗发誓,以后一定要更加注意自己的身体。
想问问大家,有没有出现过这样的情况啊?或者,大家如果有这样的情况,又没时间去医院挂号看病的话,京东互联网医院真的是性价比最高的选择。
健康没有小事,平日里大家也要多注意身体,出现不适要及时就医,不方便的话就去京东互联网医院,真的方便!


病友互助家园
文章 尿路感染:主要并发症(一)
导语:尿路感染如及时治疗,并发症很少;但伴有糖尿病和(或)存在复杂因素的尿路感染,特别是急性肾盂肾炎者,未及时治疗或治疗不当时,可出现多种并发症。

(一)肾乳头坏死
指肾乳头及其邻近肾髓质发生缺血性坏死,常发生于伴有糖尿病或尿路梗阻的肾盂肾炎,为其严重并发症。
①主要表现为寒战,高热,剧烈腰疼,腹痛和血尿等,可同时伴发革兰阴性杆菌败血症和(或)急性肾损伤。
②当有坏死组织脱落从尿中排出,阻塞输尿管时可发生肾绞痛。
③治疗上,需加强抗感染治疗。
④若坏死组织堵塞输液管,则需要通过输尿管膀胱镜取出,或置入输尿管支架解除梗阻。

(二)肾周围脓肿
为严重肾盂肾炎直接扩展而致,常存在糖尿病,尿路结石等易感因素。
①致病菌常为革兰阴性杆菌,尤其是大肠埃希菌。
②除原有症状加剧外,常出现明显的患侧腰痛,且在向健侧弯腰时疼痛加剧。
③B超,X线腹部平片,CT等检查有助于诊断。
④治疗主要是加强抗感染治疗和(或)局部手术引流。


主治医师谭可来

孙达
主治医师
肾病内科
中国医科大学附属第一医院

李苹
主治医师
肾病内科
潜江市中心医院

李星锐
主任医师
中医内科





