简称:
-
*永胜回复质量:非常满意服务态度:非常满意回复速度:非常满意functions/format.html图文问诊
-
*进玉回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*浩回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*朝江回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*冲回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*柳春回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*海华回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*秋月回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*润声回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
-
*柏康回复质量:暂无服务态度:暂无回复速度:暂无functions/format.html此用户未填写评价内容图文问诊
展开更多
-

Part.1
抑郁症是家庭问题在小孩子身上的病症表达
家庭系统是家庭关系质量中的一个重要概念。我们把家庭看成是一个系统,如果系统内的成员都是完好的,那系统就会处于稳定状态。
家庭系统内的成员彼此互动就会比较健康,彼此的心理状态也会比较健康。家庭成员之间的良性交互所产生的有形和无形的规则,共同构成了这样一种比较稳定的系统。这些成员间形成的特定的交往模式,就被称为家庭系统。
孩子作为家庭中的成员之一,如果罹患了某种心理疾病,那么实际上是因为整个家庭系统出现了问题,家庭关系的损坏造成了容易被影响的小孩出现心理疾病。抑郁症,实质上则是家庭关系问题在小孩身上的病症表达。
Part.2
孩子抑郁之前,经常会出现的四大问题
一.行为问题
多表现为打人和产生攻击行为,还可能存在多动症倾向、自闭倾向。对幼儿园和小学时期的儿童,要根据具体情况直接制定家庭规则,要做到尊重、平等,和孩子的沟通表达一定要具体、直接,态度要温和而坚定,让孩子有“赢”的感受,不要和孩子站在对立面上。
二.情绪问题:
青春期抑郁,很大一部分孩子是因为情感被隔离,父母不和、家庭氛围不好,这种环境下孩子会更容易抑郁。
在心理咨询机构的咨询过程中,父母一定要参与进来,和咨询师一起找到使孩子抑郁的原因,才能在接下来的家庭治疗中及时去调整和改变。作为家长具体要如何改变呢?第一点就是去觉察,第二是要有动力。第三是要有耐心,第四是方法要是对的、科学的,切忌用家长的权威身份去压制孩子的表达或直接拒绝沟通。
三.关系问题:
关系处理不好,孩子会焦虑, 进而可能转化为抑郁,至少孩子会自己感受到被排斥了,会假设自己不被人喜欢,u但实际上是因为孩子自己不喜欢自己。
这说明孩子的自我认同感低,父母如果自我认同感高,孩子的自我认同感也会高,如果父母和孩子关系好,一般情况下孩子跟同学的关系也不会太差。一些孩子会早恋,其实喜欢别人是正常的,家长做到正确的引导和性教育就可以了,不要给孩子带上早恋的帽子,否则孩子会因为批评产生羞愧心理。应该平日注意关注孩子的细微变化,定期和孩子进行平等交流,出了问题先要相信孩子这么做是有原因的,但不是支持孩子攻击别人,是心理上与孩子在一起,再去客观讨论事件。四.学习问题:
孩子可能会偶尔由于去学校会焦虑,所以会出现躯体问题,还可能偶尔不能完成作业,逐渐不能去上学,直至孩子完全无法去上学。
问题的原因可能比较多样,比如和同学、老师的关系不好,对学习产生抵触情绪,也可能是学习成绩达不到父母的望,这些情况下需要心理干预和父母的配合。主动和校方、老师沟通,明确孩子在学校的表现和遇到的问题,从孩子的角度出发制定解决方案。
-

若您在当前成员用户下上传错了数据,可删除当前数据后切换到对应的成员内重新上传~ 若您在病历本内的数据上传错误,即可在对应的病历卡片上,点击【移动】,选择对应的成员进行数据转移~
-

乳腺癌的风险因素有些可改变,有些不可改变。其中许多风险因素,如体重、锻炼和饮酒等,都属于可改变的生活方式危险因素,是适用于所有人包括乳腺癌高危人群可采取的预防措施。另一方面,对于乳腺癌高危人群来说,如果乳腺癌风险主要是由不可改变的风险因素驱动的,比如遗传家族史、乳腺密度高或良性乳腺疾病史,除了改变生活方式外,还需要考虑其他预防性治疗措施(如预防性手术),以降低他们的乳腺癌风险。
乳腺癌高危人群的一般建议
有或没有遗传易感性的女性
乳腺癌高危女性可分为两个亚组,有遗传倾向的女性和没有遗传倾向的女性。在这两类群体中,对乳腺癌风险的认知、心理影响、干预措施接受程度都不相同,因此必须采取 个体化预防策略。
多学科管理模式
对高危女性的干预措施很多都程度较大,而且是不可逆转的,例如,减少乳腺癌风险的预防性手术。因此,需要一个多学科小组进行管理,包括临床遗传学家、放射学家、心理学家、专业护士、乳腺外科医生、妇科医生和整形外科医生等。
生活方式改变
乳腺癌高危女性很多会选择预防性干预措施,但这些措施不能替代生活方式改变,即使采取了主要的预防性干预措施,乳腺癌的一些残余风险仍然存在。应在随访期、术后复诊时,与患者讨论生活方式改变的重要性。
药物预防措施
他莫昔芬等选择性雌激素受体调节剂(SERMs)和芳香化酶抑制剂(AIs)是乳腺癌内分泌治疗的主要药物。这两类药物对乳腺癌预防性治疗都有一定的作用。纳入3000多名参与者的9项III期试验的强有力证据显示, SERMs可使乳腺癌发病率降低约38%。
两项大型III期试验,IBIS-II和NCIC-MAP.3分别评估了阿那曲唑和依西美坦作为乳腺癌预防性治疗的效果,结果显示, AIs可降低至少50%的乳腺癌发病率,不过,这些益处仅限于预防ER阳性乳腺癌。主要的指南,如英国NICE指南、美国临床肿瘤学会(ASCO)指南、NCCN指南等,都建议医生与乳腺癌高危女性共同讨论预防性治疗策略。
长期获益
IBIS-I试验的长期随访结果(中位16年)值得关注,结果显示, 他莫昔芬在治疗后可持续降低乳腺癌的发病风险,有益作用在0-10年和10年后相似。这种较长的治疗后获益对预防性治疗策略有重要意义,而且副作用一般仅限于积极治疗期间。
有高危病变的女性获益更大
NSABP-P1试验显示,与试验中的总人群相比, 他莫昔芬对有非典型性增生女性的预防作用更大(乳腺癌风险降低:86% vs 49%)。在IBIS-II试验中,与无良性乳腺疾病的女性相比,预防性使用阿那曲唑可使有小叶原位癌(LCIS)、非典型性增生、乳腺增生的女性获得更大的益处。然而,在NCIC-MAP.3试验中,患有LCIS或非典型性增生的女性使用依西美坦获得的益处,与不伴有这些疾病的女性没有显著差异,不过该试验的中位随访时间更短,导致亚组分析的事件更少。 预防性治疗措施对有癌前病变/良性乳腺疾病的女性有更大的作用,可能也与他莫昔芬有长期持续性疗效有关。对AIs试验进行更长时间的随访将有助于探索这方面的问题。
对死亡率和肿瘤亚型的影响
没有一项乳腺癌预防性治疗试验是以乳腺癌事件或全因死亡率为终点设计的,因此,对死亡率的影响,无法得出有意义的结论。这些试验中发生的乳腺癌数量很少;由于乳腺癌存活率较高,乳腺癌死亡人数更少。此外,乳腺癌事件发生后的随访时间也不够长,如随访时间最长的IBIS-I试验的随访时间只有8年左右。对于ER阳性乳腺癌,需要更长的随访时间才能看到有意义的生存差异。
SERMs试验中观察到ER阴性肿瘤略多(160 vs 131)。目前,在AIs的试验中没有观察到这种差异性结果。 在不同肿瘤分期、不同淋巴结状态和不同肿瘤大小的亚组中,没有观察到他莫昔芬的疗效有显著差异。
研究显示在 预防ER阴性肿瘤方面缺乏益处,或此类肿瘤的发生率更高,应是BRCA1突变携带者使用他莫昔芬作为预防治疗的重要关注点,因为在这些女性中发生的乳腺癌,几乎有三分之二是ER阴性肿瘤。在BRCA2突变携带者中,这种担忧要更少。NSABP-P1试验的数据基于极少量的事件,显示他莫昔芬的获益似乎仅限于BRCA2携带者,BRCA1携带者缺乏获益。
手术预防 vs 药物预防
手术预防和药物预防的重要区别在于风险降低的程度和可逆性/不可逆性,药物预防可以灵活进行,在出现副作用时可以停止,但手术干预是不可逆的。
乳腺癌高危女性群体由2个亚组组成:已知有基因突变的女性和没有高危突变的女性。前一类人的高危状态往往在更早的时候就被发现,终身风险估计往往比后一组高得多。在监测一段时间后, 在适当的年龄进行手术降低风险往往是高危基因突变携带者的首选干预措施。然而,这段监测期提供了一个讨论和实施药物预防性治疗的机会。年轻的BRCA1突变携带者预防性使用SERMs仍存在顾虑,然而,这种顾虑不应妨碍对其他突变携带者进行个性化预防。
预防性双侧乳腺切除术(BRRM)对没有突变的高危女性的益处尚未得到证实,对侧降低风险的乳房切除术(CRRM)也未被证实能为这些高危女性带来风险降低或生存的益处。许多这样的女性在40多岁时被归入高危类别,可能接近绝经年龄,这就增加了预防性治疗的选择,包括在绝经后不久开始进行更有效的AIs预防性治疗;也可以根据对副作用的耐受性/个人偏好来选择预防措施。因此, 对于没有已知基因突变的高危女性,药物性预防可以作为预防性干预的首选。
参考文献:
Best Pract Res Clin Obstet Gynaecol. 2020; 65:18-31.京东健康互联网医院医学中心
作者:卢秀玲,毕业自北京大学公共卫生学院,曾在某知名医学网站担任医学总编辑,负责过肿瘤、心血管、内分泌等多个频道的内容产出。
-

根据世界卫生组织报告,2018年有210万例新发肺癌病例,其中土耳其、日本、中国、美国和英国的发病率最高。肺癌是一组异质性肿瘤,分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)。包括50多种不同的组织学亚型,例如,NSCLC又分为腺癌、鳞状细胞癌和大细胞癌。
近年来,肺癌治疗取得了相当大的进展,最初仅限于细胞毒化疗。化疗药物阻断细胞周期,攻击快速分裂的细胞。这种传统的治疗方法特异性较低,既会攻击正常细胞,也会攻击癌细胞,导致显著的副作用。癌症治疗的最新进展包括靶向治疗,这种药物可以阻断仅在肿瘤细胞中过度表达或过度活跃的特定分子。靶向治疗大致有三种类型:单克隆抗体、小分子抑制剂和免疫毒素。
肺癌治疗的突破主要体现在患者5年生存率的提高上,从20世纪70年代早期的10.7%上升至21世纪10年代的19.8%。然而,仍然存在一些挑战,如发现新的驱动基因改变,了解耐药机制,发现新疗法的疗效预测因子。NSCLC约占所有肺癌病例的85%,近年来晚期肺癌的治疗经历了从细胞毒性治疗到靶向治疗的转变,下文将重点关注NSCLC的治疗新靶点。
抗EGFR药物
表皮生长因子受体(EGFR)基因是NSCLC的主要驱动基因之一。2016年的一项荟萃分析发现,约32.3%的NSCLC肿瘤存在EGFR基因突变。这种突变在女性中(比男性高19.7%)、亚洲人(比北美人群高52%)、非吸烟者(比过去或者当前吸烟者高27.8%)和腺癌患者中(比其他组织类型高26.3%)更为常见。
抗EGFR治疗包括酪氨酸激酶抑制剂(TKI),是结合EGFR受体的靶向药物。第一代药物以可逆的方式与EGFR的ATP位点结合并抑制磷酸化,阻断EGFR相关的信号通路。第二代TKI通过引起EGFR的催化结构域的共价修饰,不可逆地阻断了该蛋白的酪氨酸激酶活性。第一代TKI包括厄洛替尼、吉非替尼和埃克替尼;第二代TKI包括阿法替尼和达克替尼。各种III期临床试验均显示出,晚期NSCLC中第一代和第二代TKI相比铂类化疗的益处。
第一代和第二代TKI的疗效取决于EGFR所携带的突变。大约70%的EGFR突变肿瘤对TKI有临床反应;剩下的30%对TKI药物一开始就耐药(称为原发耐药),对TKI治疗没有反应,与EGFR外显子20复制或其他突变有关,如PTEN和PIK3CA。尽管有良好的结果,第一代和第二代TKI有相当大的毒性。这些药物可能引起诸如口腔炎、腹泻、皮疹和甲沟炎等副作用,约40%的人群需要降低剂量。
靶向T790M的药物
为克服T790M导致的耐药,奥西替尼、美雷替尼和rociletinib等第三代TKI药物应运而生。这些药物不可逆地与T790M突变的EGFR蛋白高效结合,有效抑制癌症生长,第三代TKI的毒副作用更少。III期AURA研究发现,与NSCLC的标准化疗相比,奥西替尼的PFS增加了5.7个月,疾病控制率(DCR)增加了19%。FLAVUR 的 III期研究比较了奥西替尼和第一代TKI,发现PFS有所增加,从10.2个月延长到18.9个月。
ALK抑制剂
在NSCLC患者中,间变性淋巴瘤激酶(ALK)基因突变也是是药物治疗的常见靶点,约有5%的患者存在这种突变。克唑替尼是一种ALK抑制剂,在一项开放标签的3期临床试验中,针对ALK阳性晚期NSCLC的一线治疗,对克唑替尼与标准化疗的疗效进行了比较。结果显示,与化疗组相比,克唑替尼组的PFS明显更长(10.9个月vs. 7.0个月),然而,中位总生存期却没有显示出显著优势。克唑替尼组有恶心、疲劳、呕吐、食欲减退等不良反应。III期PROFILE 1014试验,也比较了克唑替尼与化疗作为ALK阳性NSCLC患者的一线治疗方案的疗效。克唑替尼每天两次,每次250mg;化疗组给予培美曲塞500 mg/m2 +顺铂75/m2或卡铂静脉注射,每3周一次,最多6个周期。结果显示,克唑替尼组的中位总生存期尚未达到,而常规化疗组的中位总生存期为47.5个月。
阿来替尼是一种高选择性ALK抑制剂。在一项随机、开放标签的3期临床试验中,研究者比较了阿来替尼(600mg,每日2次)和克唑替尼(250mg,每日2次)对ALK阳性NSCLC患者的疗效。结果显示阿来替尼组的PFS率较高(68.4% vs. 48.7%)。与克唑替尼相比,阿来替尼组的3级或5级不良事件更少(41% vs 50%)。
一项随机III期试验招募了303名以前未接受过化疗的患者,接受阿来替尼(600mg,每日两次)或克唑替尼(250mg,每日两次)治疗。在中位随访17.6个月(克唑替尼)和18.6个月(阿来替尼)期间,阿来替尼组和克唑替尼组疾病进展发生率分别为41%和68%。在阿来替尼组中有82.9%的患者有缓解,克唑替尼为75.5%。阿来替尼组3 - 5级不良事件发生率较低(41 vs 50%)。
c-MET抑制剂
c-MET蛋白是NSCLC进展的另一个关键因素,使其成为新的希望靶点。靶向c-MET激活机制的药物是治疗NSCLC的重要手段,这些药物包括MET酪氨酸激酶活性抑制剂(克唑替尼,特泊替尼,卡马替尼),针对MET(奥那妥组单抗)或HGF (利妥木单抗)的单克隆抗体。
AcSe II期试验发现,克唑替尼用于MET突变患者的ORR为36%,MET扩增患者的ORR为32%。METROS II期试验发现,接受克唑替尼治疗的MET突变或扩增患者的中位ORR为27%,PFS为4.4个月。
对卡马替尼的试验显示了更有希望的结果。卡马替尼主要靶向扩增和第14外显子突变的MET。GEOMETRY Mono-1试验研究了卡马替尼在晚期NSCLC中的疗效,结果显示ORR为71.4%,缓解持续时间为8.41个月。该研究还发现,与之前治疗的患者相比,既往未治疗过的患者PFS高了近4个月。
在对MET扩增和EGFR突变患者进行分析的II期JO28638试验中,与厄洛替尼相比,奥那妥珠单抗的ORR为68.9%,PFS为8.5个月。另一项对奥那妥珠单抗+贝伐珠单抗+培美曲塞进行的研究发现,加用奥那妥珠单抗并不能带来益处,只会增加不良反应的发生率,如外周水肿和血栓栓塞。抗HGF抗体利妥木单抗的研究中,显示DCR为60%,PFS为2.6个月。
参考文献:
J Clin Med. 2020;9(11): 3543.京东健康互联网医院医学中心
作者:卢秀玲,毕业自北京大学公共卫生学院,曾在某知名医学网站担任医学总编辑,负责过肿瘤、心血管、内分泌等多个频道的内容产出。
-

生酮饮食(KD)是一种以摄入极低碳水化合物为特征的饮食方式,碳水化合物占每日总热量的5%-10%,或每天20-50g。高脂生酮饮食(HFKD)的特点是限制碳水化合物的摄入(<50g/d),但不限制脂肪和热量。这些方法最初是用于治疗难治性癫痫,但目前广泛用于减肥。极低卡路里的生酮饮食(VLCKD)是极低卡路里饮食(VLCD)的一种亚型,也被称为保留蛋白质断食法(PSMF),通常依赖于来自乳清、大豆、鸡蛋和青豆中的蛋白质。欧洲食品安全局(EFSA)定义,当碳水化合物摄入<30-50g/天,脂肪占总热量摄入的15%-30%时,VLCD可以视为生酮饮食。要注意的是,生酮的碳水化合物和卡路里摄入量是很主观的,这使得饥饿和营养性生酮之间的界限很微妙。
饮食方案通常不会像药物那样有明确的禁忌症,因此生酮饮食也缺乏明确的适用人群说明。VLCKD是相当极端的饮食控制,如果没有医学指导,可能会导致严重的不良事件。目前,生酮饮食的应用不断增加,证据最多的领域是肥胖和难治性癫痫,在神经系统疾病、癌症、非酒精性脂肪肝、2型糖尿病和慢性疼痛等疾病的治疗中正在崭露头角。随着肥胖率逐步增加,以及新出现的应用领域,越来越多的患者可能会从生酮饮食中受益,与此带来的问题时,需要明确哪些人可以真正从生酮饮食中获益,哪些人不能采用生酮饮食。
肝脏疾病
非酒精性脂肪肝(NAFLD)是肝移植的常见原因。相关证据表明,生酮饮食在其发病机制中有保护作用,不仅仅是减肥带来的:几乎所有评估肝脏脂肪的研究都报告了各种类型生酮饮食的阳性结果,包括高脂肪饮食。
但要注意的是,营养不良是慢性肝病的常见问题。因此,2019欧洲肝脏研究协会指南建议摄入足够量的卡路里和蛋白质。为避免肝性脑病,建议优先食用植物蛋白和乳制品蛋白,减少动物(肉)蛋白的摄入量,即使存在肝硬化,也不要减少总蛋白摄入量。然而,随着全球肥胖率的上升,加上NAFLD已成为肝硬化的常见原因,超过30%的肝移植受者为肥胖,因此强烈建议这类患者减肥。一项病例系列报道称,两名终末期肝病(ESLD)患者对VLCKD治疗肥胖的耐受性良好,可有效减轻体重,无不良事件发生,并可能改善肝脏损伤。
在密切的医疗监测下,生酮饮食可能不会加重肝脏损害,相反,生酮饮食可能是有益的。因此,肝病患者可以使用生酮饮食,直到出现ESLD再停止,但还需要进一步的研究来明确推荐。
慢性肾病
肥胖是慢性肾脏疾病(CKD)公认的危险因素,同时患有严重肥胖和肾功能衰竭的患者并不少见,对这类患者不可以使用生酮饮食,因为蛋白质相对过量,可能会损害肾脏。指南对于早期CKD患者蛋白质摄入的建议尚无定论,一些建议为0.8 g/kg体重,而一些建议则高达1.4 g/kg体重。肾脏功能可能受到蛋白质来源的影响,红肉会以剂量依赖的方式损害肾脏功能,其他蛋白质来源(鱼、蛋和奶制品)的伤害较小,植物来源的蛋白质甚至可能起保护作用。
一项评估肾脏结局的系统评价称,肾脏似乎几乎不受VLCD的影响,但饮食中营养成分不同,且只纳入了肾功能正常的受试者,因此该研究的发现不适用于基线肾功能受损的患者。既往有研究表明,在轻度慢性肾病(GFR>60)患者中,VLCKD不会改变肾功能,近三分之一的患者在饮食干预后甚至出现GFR正常化。值得注意的是,VLCD依赖于乳清和植物来源的蛋白质,当需逐渐引入其他蛋白质来源时,强烈建议鱼、家禽和乳制品,而非红肉,总蛋白质摄入量要≤1.5g/kg理想体重。综上所述,现有的证据表明,VLCKD可以显著减轻体重,可能是有轻度肾病的肥胖患者的一种有效方法。
肾功能受损更严重的患者使用该饮食策略的安全性证据很少。一项为期12周针对5名肥胖和晚期糖尿病肾病患者的研究报告称,VLCKD干预后,肾功能显著改善,体重减轻。同样,5名血液透析患者接受低热量、低碳水化合物饮食,中位时间为364天,没有发生重大安全问题,体重明显减轻。但这些研究的样本量过少,因此需要谨慎评估生酮饮食对于晚期肾病患者的利弊。
1型糖尿病
由于糖尿病性酮症酸中毒和低血糖的风险增加,1型糖尿病可能是生酮饮食证据力度最强的禁忌症。但是,伴有超重的1型糖尿病患者越来越多,需要进行饮食调整。美国糖尿病协会(ADA)最新指南并未说明哪项饮食方案更优,但强烈建议对患者进行碳水化合物计算的教育。
一项回顾性研究分析了高脂生酮饮食的安全性及其改善血糖的功效,12名1型糖尿病受试者在节食时进行了严格的葡萄糖监测(每天>4次)和胰岛素治疗(<7 IU)。治疗18个月后,没有报道严重低血糖事件,A1C显著降低。最近对11名1型糖尿病受试者的连续血糖监测报告表明,高脂生酮饮食对血糖控制有益,然而,增加了低血糖风险。由于缺乏高质量的前瞻性试验,因此生酮饮食用于1型糖尿病患者是否安全尚无定论。
此外,目前的证据旨在评估生酮饮食能否改善1型糖尿病的血糖控制,而不是研究其他目的(例如减肥)。总的来说,现有的少量文献表明,仅考虑在极少数的情况下进行生酮饮食,例如伴有肥胖的1型糖尿病患者,需由经验丰富的医疗人员给予指导,同时需要持续血糖监测。需要进一步研究以明确哪些人可以使用生酮饮食。
怀孕和哺乳
目前尚无针对孕妇使用生酮饮食的临床研究,一组针对2名孕妇的病例系列表明高脂生酮饮食治疗难治性癫痫可能有致畸作用。很少有研究描述女性自发发生哺乳期酮症酸中毒,但是少数病例报告显示,生酮饮食可能导致风险增加。考虑到潜在的严重不良事件,目前可得出结论,孕妇和哺乳期女性不应采用生酮饮食。
参考文献:
Obes Rev. 2020; 21(10): e13053.京东健康互联网医院医学中心
作者:肖靖,2009-2012年就读于301医院内分泌学硕士,2012年毕业后工作于北京博爱医院内分泌科。
-
良好的术后镇痛可以减少患者的心身痛苦,缩短患者的卧床休息时间,帮助患者尽早恢复胃肠功能,减少患者术后并发症,减少住院天数。医学发展到今天,术后镇痛方式多样化,效果显著,有静脉术后镇痛,神经阻滞,椎管内术后镇痛等。
-

主动脉夹层(AD)患者,通常需要长期的药物治疗,以减少主动脉壁的压力,防止主动脉扩张或破裂。但近期的研究证据表明肾素-血管紧张素系统与主动脉瘤(AAs)的发生有关。在遗传学研究中,血管紧张素转换酶(ACE)的多态性与AA有关。对于马凡综合征患者,使用ACE抑制剂(ACEI)或血管紧张素受体阻滞剂(ARB)治疗似乎可以减缓主动脉扩张及其并发症的进展。另外的几项动物研究表明,使用ACEI或ARB治疗可以减缓AA的进展并防止其破裂。一项评估厄贝沙坦治疗马凡综合征的随机临床试验表明,ARBs降低了主动脉扩张。
下面就一项回顾性队列研究,对β受体阻滞剂、ACEI或ARB与其他抗高血压药物的相关性,以及它们与AD患者远期结局的关系进行详细分析。
数据来源
研究数据采集时间为2001年1月1日至2013年12月31日,共有6978例首次出现AD的患者符合分析条件。具体流程见(图1)
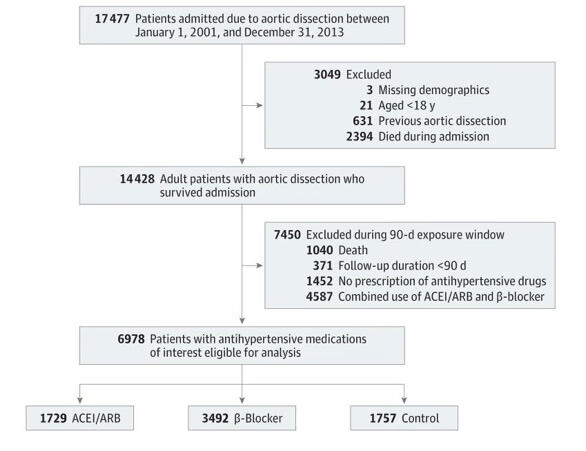
图1(图片来源于参考文献)
分析结果
-
根据使用ACEIs或ARB、β受体阻滞剂或其他抗高血压药物分层的AD患者的临床特征在图2中给出。总共1729名患者使用了ACEIs或ARB,3492名患者使用了β受体阻滞剂类,1757名患者使用了不同的降压药。单因素分析中,3个研究组的大部分临床特征均有显著性差异。年轻患者的β-受体阻滞剂组显著(平均(SD)的年龄,62.1[13.9]年β阻滞剂,68.7[13.5]年acei或arb,和69.9[13.8]年其他降压药),主要由男性患者(2520名患者(72.2%)为β阻滞剂,1161名患者(67.1%)为acei或arb,和1224名患者(69.7%)其他降压药)。药物性高血压患病率在ACEI或ARB组最高(1039例[60.1%]),其次是对照组(896例[51.0%]),而β阻断剂组最低(1577例[45.2%])。接受手术的A型AD患者更有可能使用β受体阻滞剂(1134例[32.5%]),而不是其他降压药(376例[21.4%])和ACEIs或ARBs(309例[17.9%])。调整多倾向评分后,3组间任何临床特征均无显著差异。
-
从2001年到2013年,β阻断剂的使用稳步增加(52%-64.2%;P < 0.001为趋势)。从2001年到2013年,ACEI或ARB联合组的使用也有所增加(39.6%-51.2%;P < 0.001为趋势)。2001年至2013年,仅采用ARB评估法的患者人数稳步上升(18.8%-47.2%;P < 0.001为趋势),而单独使用ACEI评估的患者在这些年间减少了(22.4%5.0%;P < 0.001为趋势)。
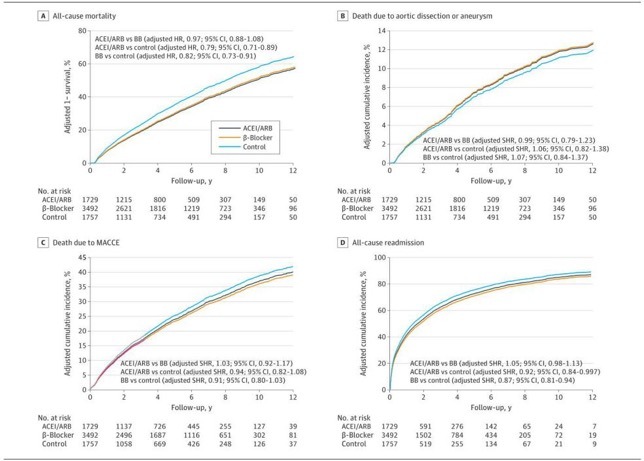
图2(图片来源于参考文献)
-
在ACEI或ARB组和β阻滞剂组之间,有价值的分析指标包括全原因死亡率、AD或AA死亡、重复主动脉手术、MACCE、因任何原因再次住院以及新发生的透析,没有显著差异(图1)。然而,血管紧张素转换酶抑制剂或血管紧张素转换酶抑制剂组(危险比为0.79;95%可信区间为0.71-0.89)和β阻滞剂组(危险比为0.82;95%可信区间为0.73-0.91)均低于对照组(图2A)。虽然AD或AA导致的死亡和综合预后风险在3组之间没有显著差异,但ACEI或ARB组(亚分布HR,0.92;95%CI,0.84-0.997)和β阻滞剂组(亚分布HR,0.87;95%CI,0.81-0.94)的全原因再住院风险显著低于对照组(图2B-D)。不同组之间阴性对照结果(即骨折或恶性肿瘤)的风险没有差异。
-
使用ARB或ACEI的AD患者的基线特征在反转治疗加权概率后,两组之间没有显著差异。图3显示了结果分析的结果。ARB组的死亡率低于ACEI组(HR,0.85;95%CI,0.76-0.95)。ARB组的AD或AA死亡率似乎较低(亚分布HR,0.81;95%CI,0.64-1.03),尽管这一发现没有统计学意义(P=0.09)。此外,两组之间阴性对照结果的风险没有差异(图3)。
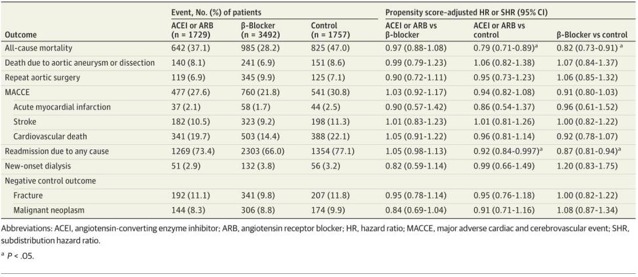
图3(图片来源于参考文献)
-
全因死亡率和由AD或AA引起的死亡的敏感性分析数据是通过使用药物使用作为治疗的时变暴露而获得的。单独使用血管紧张素转换酶抑制剂或血管紧张素转换酶抑制剂或单独使用β阻滞剂与全因死亡率和死于AD或AA的风险较低(但在统计学上不显着)相关。然而,使用血管紧张素转换酶抑制剂或血管紧张素转换酶结合β阻滞剂显著降低了全因死亡率(HR,0.68;95%CI,0.56-0.83)和死于AD或AA的风险(HR,0.64;95%CI,0.47-0.88)。ARB与ACEI的比较结果与初步分析一致,即ARB显著降低全因死亡率(HR,0.72;95%CI,0.63-0.82)和AD或AA死亡(HR,0.71;95%CI,0.58-0.87)。
-
与使用CCB相比,使用血管紧张素转换酶抑制剂或血管紧张素转换酶抑制剂(HR,0.76;95%CI,0.65-0.88)或使用β阻滞剂(HR,0.86;95%CI,0.75-0.995)可显著降低全因死亡的风险。使用血管紧张素转换酶抑制剂或血管紧张素转换酶抑制剂而不是β阻滞剂与较低的AD或AA死亡风险相关(HR,0.67;95%CI,0.48-0.94)。
结果讨论
-
在分析结果中可发现,β阻滞剂和血管紧张素转换酶抑制剂或血管紧张素转换酶抑制剂与其倾向得分匹配的对照组相比,全因死亡率和因任何原因再次住院的风险都较低。ARB治疗组的全因死亡风险低于ACEI治疗组,与ACEI相比,ARB的全因死亡率较低。
-
在肾素-血管紧张素系统中,ACEI具有AT1R和AT2R双重阻断作用,而ARB则具有AT1R阻断作用。只有氯沙坦可以通过AT2Rs持续传递信号来唯一地抑制转化生长因子-β介导的细胞外信号调节激酶的激活。这些结果表明,在通过转化生长因子-β介导的细胞外信号调节激酶的激活来防止主动脉根部扩张方面,氯沙坦可能优于ACEIs。尽管这些研究表明ARB是改善马凡综合征病程的一种有前途的药物,但ACEI或ARB治疗其他动脉瘤的意义尚不清楚。氯沙坦不仅阻断转化生长因子-β信号转导,而且通过阻断AT1R来阻止血管紧张素Ⅱ信号转导,AT1R可能在某些形式的动脉瘤中被激活。合理推测ARB可能对治疗更常见的非遗传性AA有有益效果。
-
β阻滞剂的使用与A型AD手术后存活率的提高有关,而CCBS的使用与B型AD的内科治疗患者存活率的提高有关,血管紧张素转换酶抑制剂的使用与生存无关。然而,CCBS的这种益处还没有在其他研究中显示出来,CCBS不推荐用于遗传性胸主动脉疾病患者。ACEI、ARB或β阻滞剂的使用是与A型和B型AD的全因死亡率降低有关。
-
使用ACEI或ARB和β阻滞剂,而不是使用CCB,与显著降低全因死亡率相关。
总结
与对照组相比,使用β阻滞剂和血管紧张素转换酶抑制剂(ACEI)或血管紧张素转换酶抑制剂(ARB)可降低死亡率和因任何原因再次住院的风险。这些数据提供了证据,表明血管紧张素转换酶抑制剂和血管紧张素转换酶B疗法可能是长期治疗AD的β阻滞剂的替代品。
参考文献:JAMA Network Open.2021;4(3):e210469. doi:10.1001/jamanetworkopen.2021.0469
京东健康互联网医院医学中心
作者简介:陈民,天津医科大学,硕士研究生,硕士研究生期间主攻方向为心内科,对冠心病、心衰、先天性心脏病等常见心内科疾病有深入的研究及丰富的临床经验。
-
-
非小细胞肺癌 (NSCLC) 占所有肺癌病例的 85%,其中 15-30% 是肺鳞状细胞癌。许多研究已经深入探索了NSCLC的致病基因,基于基因分型的靶向治疗已经成为非常成功的治疗方法。近年来,PD-1/ PD-L1抑制剂已逐渐成为NSCLC患者一线或二线治疗的标准疗法。
两种抗PD-1 抗体(纳武单抗和派姆单抗)以及两种抗PD-L1抗体(阿特珠单抗和德瓦鲁单抗)已被批准用于治疗NSCLC。本文旨在概述PD-1/PD-L1 抑制剂用于 NSCLC 患者的一线、二线和三线治疗的最新进展。
目前NSCLC的治疗方案很多,包括放疗、铂类化疗、手术切除和分子靶向治疗等,但长期疗效仍然不甚理想,5年生存率低于18%。因此,迫切需要具有较低毒性和较高疗效的新型临床疗法,进一步延长患者的生存时间。目前,部分抗PD-1/PD-L1抗体已获得批准用于晚期NSCLC的治疗。
PD-1/PD-L1 抑制剂用于一线治疗
多项 KEYNOTE 试验正在研究各种肿瘤类型中使用 PD-1/PD-L1 抑制剂的效果,NSCLC患者是关注的重点人群。在开放标签的 Ib 期 KEYNOTE-001 试验中,肿瘤组织表达PD-L1的晚期 NSCLC 患者, 接受派姆单抗治疗后,客观缓解率 (ORR) 为 27%,中位无进展生存期(mPFS)为 6.2 个月,中位总生存期 (mOS) 为 22.1 个月。PD-L1 肿瘤比例评分 (TPS) ≥ 50% 的患者,ORR、1 年 mPFS 和 1 年 mOS 均显著高于总体人群。结果表明,派姆单抗耐受性良好。
对于晚期鳞状 NSCLC 患者,KEYNOTE-407 试验表明,与单独传统化疗(卡铂+紫杉醇)相比,卡铂加紫杉醇和派姆单抗联合治疗组的 mOS 和 mPFS更长。KEYNOTE-407最终分析的疗效结果显示,在中位随访 14.3个月后,与安慰剂联合化疗相比,派姆单抗联合化疗的 mOS(17.1 个月 vs. 11.6 个月)和 mPFS(8.0 个月vs. 5.1 个月)均得到明显改善。
在 CheckMate 012 试验中,52 名患者接受纳武单抗治疗,直至出现疾病进展或出现毒性。整体来讲,患者的 ORR 为 28%,mPFS 和 mOS 分别为 3.6 个月和 19.4 个月。
另一项开放标签的 I 期试验CheckMate 012中,对 78 名接受纳武单抗(两周一次)加伊匹单抗(12周一次),或纳武单抗(两周一次)加伊匹单抗(6周一次)的患者进行了评估。 纳武单抗加伊匹单抗作为一线治疗获得了良好的耐受性和安全性,临床疗效令人鼓舞,每组都有较好的 ORR。在CheckMate 227试验中,相比单独化疗,纳武单抗联合伊匹单抗作为一线治疗晚期NSCLC患者的mPFS明显延长。
阿特珠单抗和德瓦鲁单抗是针对 PD-L1 免疫球蛋白 G1的单克隆抗体,可与 PD-L1 结合阻断PD-1/PD-L1介导的信号通路。BIRCH试验旨在衡量阿特珠单抗作为一线、二线和三线疗法在晚期 NSCLC 中的疗效。 在接受阿特珠单抗一线治疗的 139 名晚期 NSCLC 患者中,ORR、mPFS 和 mOS 分别为 22%、5.4 个月和 20.1 个月。
IMpower150是一项开放标签的III期研究,旨在评估阿特珠单抗联合贝伐珠单抗和化疗用于晚期NSCLC患者一线治疗的疗效。患者接受阿特珠单抗+卡铂+紫杉醇(ACP),或贝伐珠单抗+卡铂+紫杉醇(BCP),或阿特珠单抗+贝伐珠单抗+卡铂+紫杉醇(ABCP)治疗。结果显示,无论PD-L1的表达水平和遗传状态如何,与ACP或BCP组相比,ABCP组中转移性非鳞状NSCLC患者的mPFS和mOS均显著改善。
在 Ib 期试验中,德瓦鲁单抗和抗 CTLA-4 抗体替西木单抗被用于治疗晚期 NSCLC 患者。整体来讲,德瓦鲁单抗联合替西木单抗组的 ORR 为 23%。MYSTIC 试验是一项开放标签的 III 期试验,在晚期 NSCLC 患者中比较德瓦鲁单抗联合或不联合替西木单抗与单独铂类化疗用于一线治疗的效果。在肿瘤细胞 PD-L1 表达⩾25%的患者中,与单独化疗相比,德瓦鲁单抗组在 mOS 方面出现明显改善。
PD-1/PD-L1 抑制剂用于二线治疗
抗 PD-1抗体 纳武单抗是第一个被批准作为 IV 期 NSCLC 的二线治疗药物。CheckMate 017,一项随机、开放标签、III 期研究,评估了纳武单抗治疗晚期鳞状NSCLC的疗效和安全性;在一线化疗期间或之后获得了更大的疗效。无论 PD-L1 表达水平如何,纳武利尤单组的 mOS、ORR 和 mPFS 均明显优于多西他赛组。
KEYNOTE-010 是一项开放标签、随机 II/III 期试验,纳入接受过派姆单抗或多西他赛治疗的肿瘤细胞中PD-L1表达水平⩾1% 的NSCLC 患者。研究表明,派姆单抗治疗可显著延长既往接受过治疗的晚期 NSCLC 患者的 mOS,尤其是那些 PD-L1 表达水平高的患者。
一项随机 III 期临床试验 OAK研究表明,无论 PD-L1 的表达水平如何,与多西他赛相比,阿特珠单抗治疗后的生存率都有明显提高。基于 OAK 的研究结果, 阿特珠单抗已被 FDA 和EMA 批准用于治疗先前接受过其他疗法的晚期 NSCLC 患者。研究显示,阿特珠单抗组的患者,ORR为14%,mOS为13.8 个月。
PD-1/PD-L1 抑制剂用于三线治疗
BIRCH 研究检查了阿特珠单抗作为晚期 NSCLC 的三线或更后线治疗的临床疗效。阿特珠单抗作为三线治疗,mOS、mPFS和ORR分别为13.2个,2.8个月和18%,表明 阿特珠单抗作为三线治疗晚期NSCLC具有良好的临床疗效。
ATLANTIC试验,旨在评估德瓦鲁单抗用于晚期 NSCLC患者的三线或更后线治疗的疗效。PD-L1表达水平⩾25%的EGFR阳性和ALK阳性患者接受德瓦鲁单抗治疗的ORR为12.2%, PD-L1表达水平⩾25%的EGFR阴性和ALK阴性患者的ORR为16.4%,PD-L1表达水平 ⩾ 90% 的患者为30.9%。三组的 mPFS分别为1.9个月、3.3个月和2.4个月。
ARCTIC试验在晚期NSCLC患者中评估了德瓦鲁单抗联合或不联合替西木单抗作为三线以后治疗的疗效。对于 PD-L1⩾25%的患者,与标准治疗相比,德瓦鲁单抗可显著改善 mOS 和 mPFS。对于PD-L1表达<25%的患者,与标准治疗相比,德瓦鲁单抗联合替西木单抗可显著改善mOS。
总结
迄今为止,四种抗PD-1/PD-L1药物,包括纳武单抗、派姆单抗、阿特珠单抗和德瓦鲁单抗,已被批准用于NSCLC的新辅助、一线和二线治疗。随着免疫检查点抑制剂的获批,基于调节PD-1/PD-L1信号的免疫检查点疗法为晚期NSCLC患者的治疗提供了更多选择。
参考文献:
Ther Adv Med Oncol. 2021; 13:1758835921992968.
京东健康互联网医院医学中心
作者:刘山水,医学博士、副教授。研究疾病领域为老年疾病及常见慢病,已在国内外医学期刊发表署名论文80余篇。
-

概述:
腰椎管狭窄的患者,主要表现为下肢感觉以及运动功能障碍。大多数患者首先出现反复腰痛,之后可引起臀部和腿部疼痛。部分患者可因为椎管狭窄压迫马尾神经,导致出现马尾综合征,表现为患者大小便失禁以及鞍区感觉异常。患者还会因为腰椎管狭窄而出现间歇性跛行,具体表现为行走一段路程之后,出现一侧或者双侧下肢麻木疼痛及无力,被迫休息后才可继续行走。
治疗建议:
对于腰椎管狭窄的患者,可选择药物治疗或者手术治疗。药物选择可以服用非甾体类抗炎药,来减轻疼痛症状,比如布洛芬、塞来昔布等。也可以服用神经营养性药物来促进周围神经的恢复,改善神经功能,比如甲钴胺等。或者可配合使用肌肉松弛剂来改善肌肉紧张状态,缓解疼痛,比如乙哌立松以及氯唑沙宗,而对于服用药物无效症状较重的患者,可推荐手术治疗。
日常注意:
腰椎管狭窄患者,应该养成良好的生活以及运动习惯,来改善病情。首先,患者应该加强腰背部肌肉的训练,增强脊柱的内在稳定性,防止因为肌肉萎缩而带来不良后果。其次,患者应该保持良好的站立以及端坐姿势,同一姿势不能保持太久,应该适当进行活动,解除腰背部肌肉疲劳。最后,患者应该合理饮食,保持合理体重,减少脊柱负荷。
展开更多
展开更多








