当前位置:首页>
乙肝表面抗原是阴性的,医生却让我吃抗乙肝病毒药物
70岁的黄阿姨不久前确诊了淋巴瘤。血液科医师评估了她的身体情况,建议她做化疗,计划选择R-CHOP方案(注:一种包含利妥昔单抗的化疗方案),同时还建议她尽快来感染科咨询。这是为什么?
来看看黄阿姨和我们感染科X医师的对话吧~
黄阿姨:X医师您好,我得淋巴瘤了,是从血液科过来的,那边的大夫说我乙肝检查结果有问题,让我尽快来看看。可是我从来没有得过乙肝,我的家人也从来没有得乙肝的。我觉得挺奇怪的,我是不是真的得乙肝了?现在的我有没有传染性,会不会影响我的家人?
X医师:黄阿姨,您好。您别着急,让我先看看您的病历和化验结果。
黄阿姨的化验结果显示:
乙肝五项:乙肝核心抗体阳性,其余四项(乙肝表面抗原、乙肝表面抗体、乙肝e抗原和乙肝e抗体)都阴性;
乙肝病毒核酸(HBV DNA):未检测到靶标。
肝生化指标无异常(转氨酶、胆红素指标都是正常的),腹部超声没有提示异常。
这提示她过去曾经感染过乙肝病毒,但是目前肝脏无明显损伤。
X医师:您的化验结果提示过去曾经感染过乙肝病毒,但是您的身体免疫力不错,自己就把血液里面的乙肝病毒清除掉了。乙肝表面抗原是阴性的,乙肝病毒核酸也是阴性的,目前血液里面没有病毒,没有传染性,您不用担心。
黄阿姨:太好了,那我就放心啦,谢谢X大夫。那我是不是就可以走了?
刚想起身的黄阿姨突然想起一个问题:但是血液科大夫为什么还是让我来找您看病呢?
X医师:尽管您目前血液中没有乙肝病毒复制,但是在接受淋巴瘤化疗期间,身体免疫功能会明显下降,这时候存在较高的乙肝病毒再激活风险。建议您吃上抗乙肝病毒的药物来尽量避免这种风险。
黄阿姨:什么是乙肝病毒再激活?我的血液里面没有乙肝病毒,为什么还要吃药呢?
X医师:您可以把“乙肝病毒再激活”理解为乙肝病毒死灰复燃。免疫功能正常情况下,乙肝病毒已经被控制了,不会到血液里面来捣乱。在接受化疗后,免疫功能明显下降,乙肝病毒会趁机捣乱,再次活跃,从而导致急性肝炎,如果不及时治疗,甚至会导致肝衰竭。避免这种风险的最好方法,是口服抗乙肝病毒的药物。
黄阿姨:那我明白啦,这种情况叫防患于未然。谢谢您!
科普时间
乙肝表面抗原(HBsAg)是乙肝病毒感染的常用标记物,其血液检测结果阳性代表乙肝病毒感染,往往需要抗病毒治疗。如果其血液检测结果阴性,多数情况下不需要抗病毒治疗,但也有例外。
最常见的例外,就是乙肝病毒再激活高风险情况下,需要抗病毒治疗。
按照中国药物性肝损伤指南(2023年版),包括利妥昔单抗在内的多种药物属于乙肝病毒再激活高风险药物(详见下方图片)。
(图片来源:中国药物性肝损伤指南(2023年版)
我们团队曾报道一例淋巴瘤患者接受R-CHOP化疗结束后19个月HBV再激活的案例。
(图片来源:Guo X, Ji T, Xin S, Xu J (徐京杭) , Yu Y. A case report of hepatitis B virus reactivation 19 months after cessation of chemotherapy with rituximab. Front Immunol. 2022 Dec 2;13:1083862. doi: 10.3389/fimmu.2022.1083862. PMID: 36532005; PMCID: PMC9755885.)
这些药物的使用场景丰富,可见于血液科、皮肤科、肾内科、肿瘤科等。多学科之间的协作是患者安全的重要保障。
本站内容仅供医学知识科普使用,任何关于疾病、用药建议都不能替代执业医师当面诊断,请谨慎参阅
-
总交流次数
37
医生回复次数
22
患者:女
-
丙酚替诺福韦(TAF)作为强效低耐药的核苷酸类似物药物,在慢性乙型肝炎(CHB)中的治疗价值已得到高度认可,但随着抗病毒治疗效果的改善,CHB治疗中也出现了一些需要应对的新问题,如对慢性非传染性疾病较多的老年患者、肝/肾功能损伤患者等群体,抗病毒方案的选择就需要细化。近年来多项临床研究已显示,TAF用于CHB多种不同患者人群有着良好的有效性和安全性[1-2],而各种真实世界研究进一步证实了TAF的治疗价值,本文将对多项相关研究进行解读。
低病毒血症患者改用TAF,可改善病毒学应答状况
对经治且存在低病毒血症(LLV,美国AASLD指南定义为HBVDNA20~2000IU/mL[3])的患者,换用TAF治疗有望提升完全病毒学应答(CVR)比例。如日本多中心、回顾性KULDS研究,共入组313例≥20岁,治疗至少2年的经治CHB患者,其中191例接受恩替卡韦(ETV)治疗,122例接受其他核苷(酸)类似物(NA)联合治疗治疗。
研究评估患者换用TAF治疗48周时的疗效及肾脏安全性,其中ETV经治患者基线有34例LLV患者,换用TAF治疗48周后33例达到CVR(HBVDNA≤20IU/mL),比例高达97.1%;基于TDF或ADV的NA联合治疗组基线有9例LLV患者,换用TAF治疗后也有7例达到CVR[4]。
我国学者开展的一项前瞻性、单中心真实世界研究[5],共入组211例ETV单药治疗≥48周后为LLV的CHB患者,按患者意愿继续ETV单药治疗(109例)或换用TAF(102例),评价治疗24周时的CVR(HBVDNA<20IU/mL)比例,次要终点包括HBVDNA下降程度及ALT复常率,安全性终点包括治疗不良事件、肾功能变化等,其中150例患者纳入倾向性评分匹配(PSM)队列,继续ETV治疗和换用TAF的患者各有75例,组间基线特征整体相近。
不论是在PSM队列还是在原始队列(RAW队列)中,治疗12、24周时换用TAF组患者的CVR比例(见图1)均显著高于ETV单药治疗组;治疗24周时在PSM队列中,换用TAF患者HBVDNA定量平均降幅为1.99log10IU/ml,显著高于ETV组的0.76log10IU/ml(p=0.002),RAW队列中降幅则分别为2.2log10IU/ml和0.74log10IU/ml,TAF组降幅仍显著更高(p<0.001)。
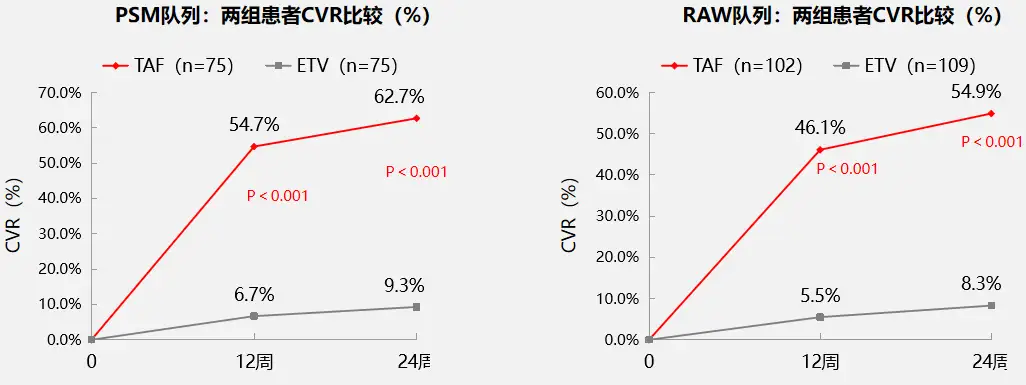
图1两组LLV患者CVR情况比较
按中心实验室标准或2018年AASLD标准评价的ALT复常率,至24周时不论是PSM队列还是RAW队列,TAF组均显著高于ETV组(见图2,12周时PSM队列TAF组的ALT复常率数值上更高,但差异尚未达到统计学显著性),但无论在PSM或RAW队列中,两组患者HBeAg转阴率/血清转换率、qHBsAg变化等HBV生物标志物变化,肝硬度测量等无创性肝纤维化测量结果均无显著差异。
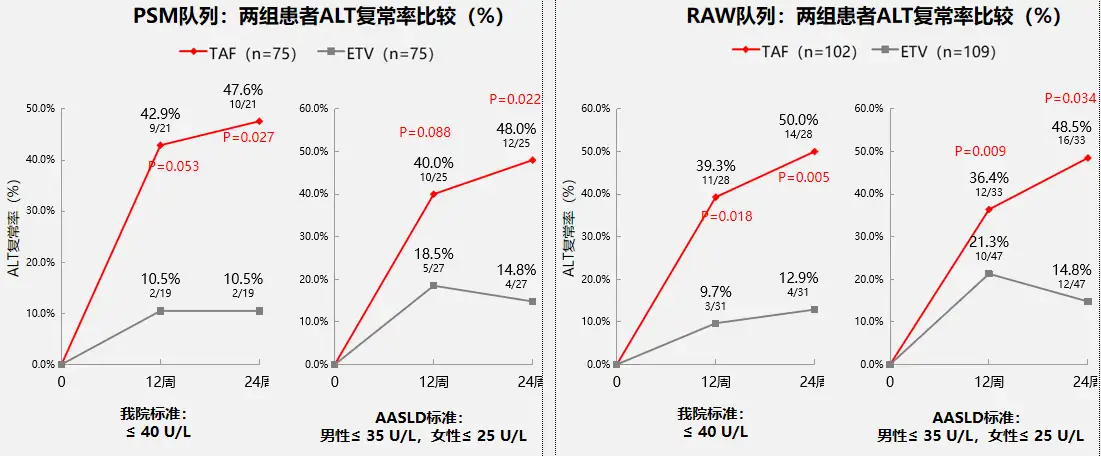
图2两组患者ALT复常率比较
安全性终点方面数据显示,换用TAF组与继续ETV单药治疗耐受性均较好,两组不良事件、严重不良事件和实验室指标异常的发生率相似,且绝大部分不良事件均为轻中度,在整个随访期间两组均无患者因不良事件而停药,PSM队列中治疗24周时,两组平均估算肾小球滤过率(eGFR)下降程度无显著差异(1.1%/1.5%,p=0.707)。这项研究数据为ETV治疗后出现LLV的患者,换用TAF治疗提供了疗效和安全性证据。
其它NA应答不佳患者,换用TAF可实现良好病毒学应答
虽然近年来在CHB抗病毒治疗中,TAF等高耐药屏障药物已经成为主要选择,但我国曾广泛应用LAM等低耐药屏障药物,多项HBV耐药监测研究显示,我国经治CHB患者中约40%存在耐药相关突变,其中LAM耐药相关位点最为常见[6-7],且ETV与LAM等药物存在交叉耐药。而目前尚未发现TAF存在与其它NAs的交叉耐药,因此对存在LAM、ETV等药物耐药位点,其它NAs治疗应答不佳的患者,使用TAF可能是较好的治疗选择。
2020年AASLD年会上发表的一项日本前瞻性真实世界研究[8],共纳入38例其它NAs应答不佳(定义为病毒学突破,即HBVDNA相对最低值上升≥1log10IU/mL和/或NAs经治超过1年HBVDNA仍≥2log10IU/ml,维持不完全病毒学抑制)的CHB患者,评估换用TAF治疗1年后的病毒学应答(HBVDNA<10IU/mL)情况,并根据患者基因型耐药位点,对疗效进行分层分析。
7例此前接受过TDF治疗的患者,仅2例(28.6%)接受TAF治疗后达到病毒学应答;31例此前治疗方案不含TDF的患者,换用TAF治疗后25例(80.6%)达到病毒学应答(p=0.014),根据耐药位点进行的分层分析如图[YL27]3所示,基线高HBVDNA[YL28][V29]水平(≥4.3log10IU/ml)且[YL30]HBeAg阳性和对TDF应答不佳,[YL31]与换用TAF治疗病毒学应答比例较低有关。因此对其它NAs应答不佳,尤其是LAM/ETV耐药的难治患者,换用TAF可取得良好的病毒学应答。
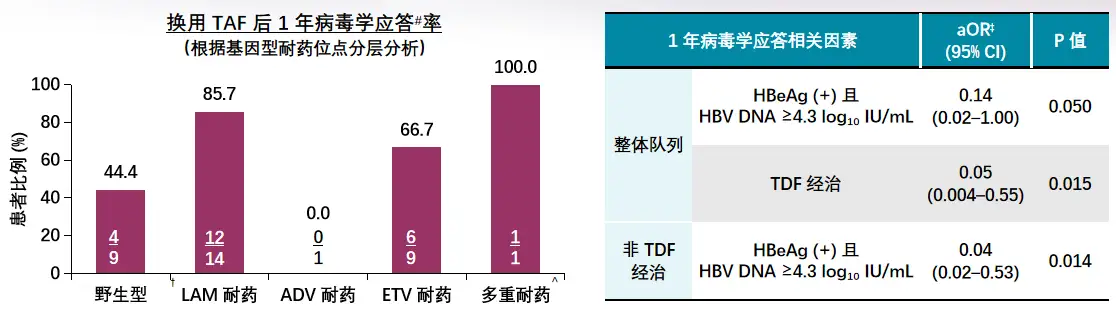
图3其它NAs应答不佳患者换用TAF治疗后的病毒学应答情况
经治患者换用TAF,短期和长期数据均提示肾脏安全性改善
上文列举的多项经治CHB患者换用TAF真实世界研究,大多对eGFR等肾功能指标进行过分析,评价TAF治疗的肾脏安全性,还有一些真实世界研究则专门从这一角度出发,评价CHB患者换用TAF后,肾功能指标、近端肾小管标志物的变化情况。
例如一项入组72例TDF经治CHB患者的单中心、前瞻性真实世界研究显示,患者换用TAF治疗24周后,近端肾小管标志物水平即显著下降,β2M:Cr比值从基线时的1.5降至1.1(p<0.01)、视黄醇结合蛋白(RBP):Cr比值从基线时的1.7降至1.4(P<0.01)[9],治疗72周时两种标志物仍维持较基线时显著下降的状态(P<0.01),且仅有两例CKD2期患者进展至3期,提示患者整体肾功能维持较好[10]。
一项加拿大真实世界研究[11]共纳入176例基线eGFR为60-90mL/min/1.73㎡,即已存在轻度肾功能损伤,且使用TAF治疗的CHB患者,其中126例(73%)为TDF换用TAF,43例(25%)为其它NAs换用TAF,其余为初治CHB患者,随访评估TAF治疗期间(最长随访160周)的肾功能指标变化情况。
研究数据显示,患者此前在TDF治疗期间,eGFR每月平均下降0.18mL/min/1.73㎡(p=0.008),但换用TAF治疗后,eGFR指标维持稳定(±0.00mL/min/1.73㎡,p=0.02,见图13),血磷也有改善趋势(TAF治疗后上升1.0log10IU/mL,p=0.2),提示从TDF换用TAF后患者肾功能指标有改善趋势。
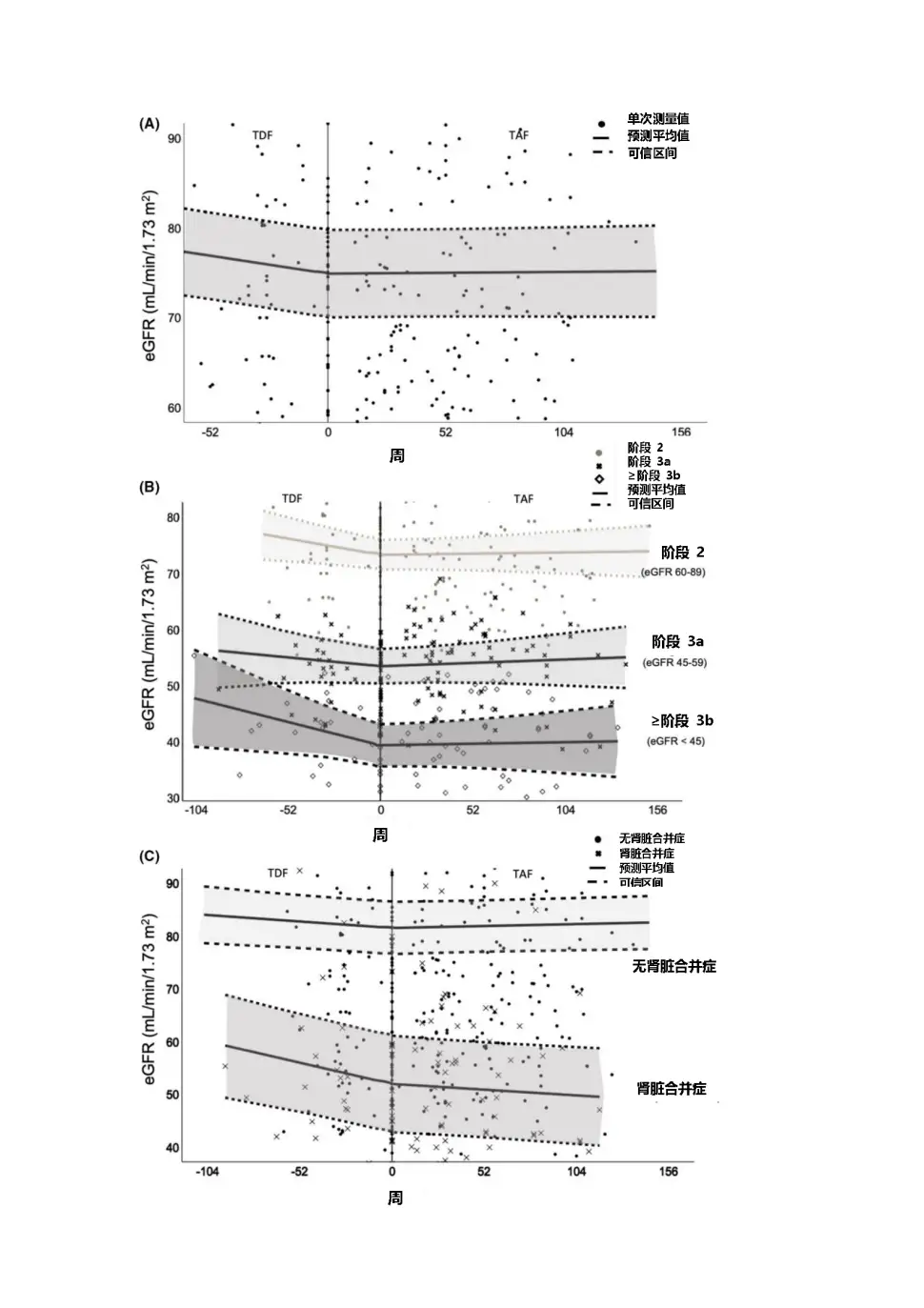
图4患者换用TAF前后的eGFR指标变化情况
2020年AASLD年会上一项意大利前瞻性、真实世界研究[12],评价了从TDF±ADV换用TAF治疗后,患者近端肾小管标志物的早期变化,研究共入组146例TDF经治CHB患者,基线特征如表1所示,患者主要因符合2017年EASL指南中年龄或骨肾风险标准而换用TAF治疗。
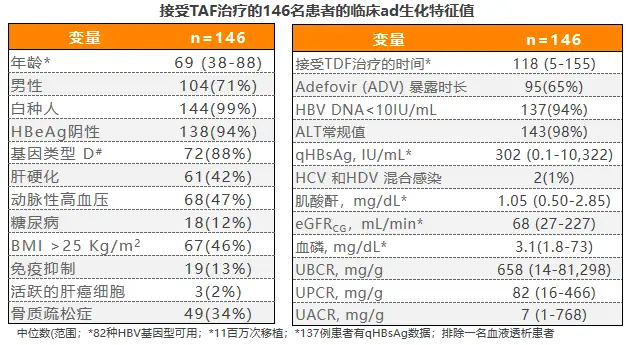
表1患者基线特征情况
患者换用TAF治疗6个月时,病毒学应答率维持稳定,ALT无明显变化,无患者因治疗不良事件停药。换用TAF治疗2个月后,患者β2M:Cr由基线时的658mg/g降至433mg/g,治疗6个月时进一步降至315mg/g;77例基线β2M:Cr异常患者中,24例在6个月时复常;此外患者尿蛋白/肌酐比(UPCR)整体明显下降,MDRD公式估算的eGFR维持稳定,提示换用TAF后肾功能保持良好,换用TAF能快速改善近端肾小管功能(见表2)。
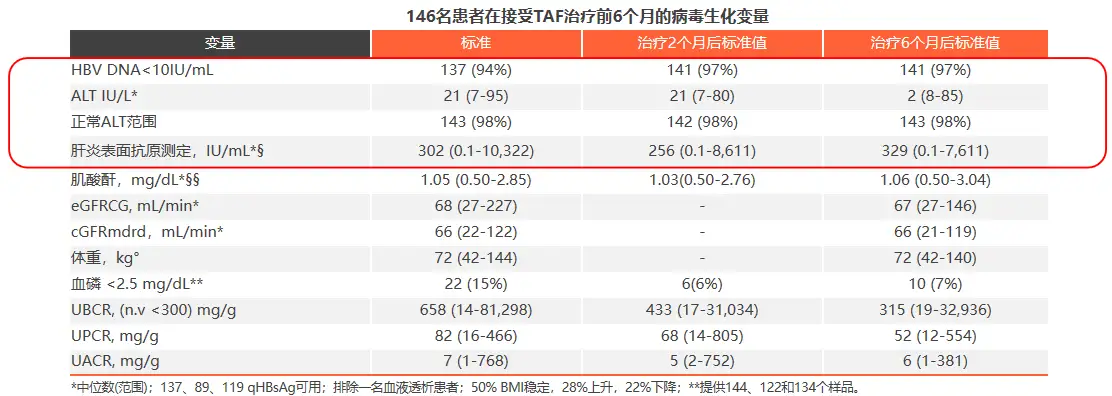
表2患者病毒学与生化特征指标变化情况
换用TAF治疗对血脂影响小,合并糖尿病的患者用药安全性良好
在TAF的关键临床研究108/110中,患者由TDF转换为TAF治疗时,会出现总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)等血脂指标的小幅上升[13],但有研究认为其原因是TDF治疗导致的血脂下降,并不能认为TAF有“升高患者血脂”,甚至增加心血管风险的作用[14]。
2021年亚太肝病研究学会(APASL)年会上,两项来自中国的真实世界研究提供了TAF治疗对CHB患者血脂水平影响的最新数据,第一项单中心、回顾性队列研究[15]共纳入499例ETV单药治疗≥12个月,且应答不佳(定义为HBVDNA水平30-2000IU/mL)的CHB患者,其中104例换用TAF治疗,剩余患者继续使用ETV,两组患者除年龄外的基线特征无显著差异,研究评价治疗24周时治疗的病毒学、生化学应答和患者血脂变化情况。
由ETV转换为TAF治疗24周后,79.4%患者达到病毒学应答(HBVDNA<30IU/mL),显著优于继续使用ETV组的9.1%(p<0.001);TAF治疗组24周时ALT正常(<40U/L)比例为92.6%,显著优于ETV组的80.6%(p=0.014),提示换用TAF后治疗生化学应答有所改善。而对换用TAF治疗组中31例患者进行的血脂水平分析显示,治疗24周时患者TC、TG、LDL-C、HDL-C水平较基线时无显著变化(见表3)。
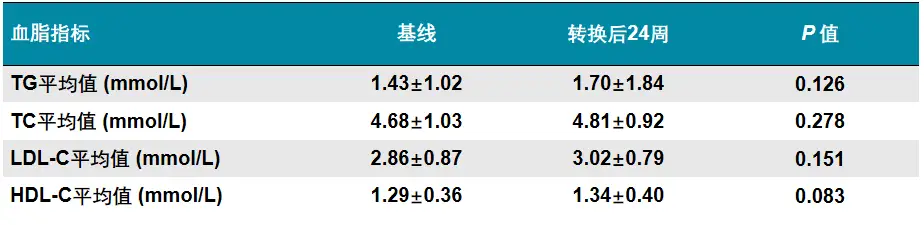
表3ETV治疗应答不佳患者换用TAF后血脂变化
另一项我国单中心真实世界研究[16],则评价了TAF用于合并糖尿病CHB患者的血脂水平变化情况,入组的34例患者中有28例为其它NA经治患者。换用TAF治疗24周时的血脂指标显示,患者TC、TG、LDL-C、HDL-C水平及TC/HDL比值较基线时无显著变化(见表4),且初治CHB患者、由TDF换用TAF患者、由ETV换用TAF患者亚组结论与整体人群相似。此研究结果显示TAF用于慢性肾脏病风险相对较高的糖尿病患者,不会显著影响血脂水平。
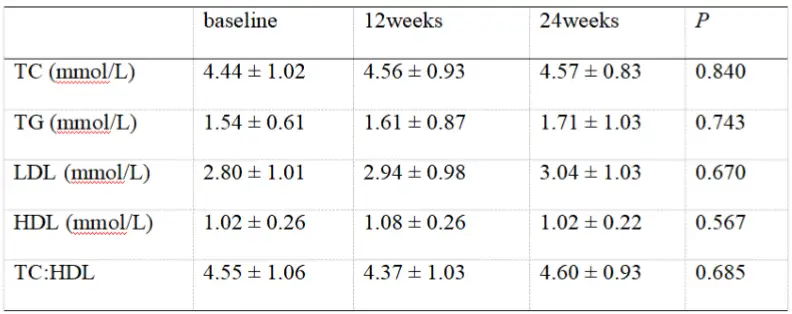
表4TAF治疗合并糖尿病CHB患者24周时的血脂变化
结语
用于LLV患者、其它NAs应答不佳患者等临床情况状况各异的人群时,TAF治疗都体现了良好的抗病毒效果和肾脏安全性,这为TAF成为多种不同患者人群的优选治疗方案提供了重要依据,对临床实践也有很大的参考意义。未来随着TAF治疗的数据和经验不断积累,还会有更多真实世界研究提供更全面、细致的信息,更好地指导TAF的临床应用。
参考文献:
1.JanssenHLA,etal.EASL2021,AbstractPO-2395.
2.LimYS,etal.EASL2021,AbstractPO-2338.
3.TerraultNA,LokASF,McMahonBJ,etal.Updateonprevention,diagnosis,andtreatmentofchronichepatitisB:AASLD2018hepatitisBguidance[J].Hepatology,2018,67(4):1560-1599.
4.OgawaE,NomuraH,NakamutaM,etal.Tenofoviralafenamideafterswitchingfromentecavirornucleos(t)idecombinationtherapyforpatientswithchronichepatitisB[J].LiverInternational,2020,40(7):1578-1589.
5.LiZB,LiL,NiuXX,etal.SwitchingfromentecavirtotenofoviralafenamideforchronichepatitisBpatientswithlow‐levelviraemia[J].LiverInternational,2021,41(6):1254-1264.
6.LiX,LiuY,XinS,etal.Comparisonofdetectionrateandmutationalpatternofdrug-resistantmutationsbetweenalargecohortofgenotypeBandgenotypeChepatitisBvirus-infectedpatientsinNorthChina[J].MicrobialDrugResistance,2017,23(4):516-522.
7.GuoX,WuJ,WeiF,etal.TrendsinhepatitisBvirusresistancetonucleoside/nucleotideanaloguesinNorthChinafrom2009–2016:aretrospectivestudy[J].InternationalJournalofAntimicrobialAgents,2018,52(2):201-209.
8.HosakaT,etal.AASLD2020,Abstract817.
9.FongTL,etal.DDW2018,AbstractSa1499.
10.LeeBT,ChangM,LimC,etal.Boneandrenalsafetyprofileat72weeksafterswitchingtotenofoviralafenamideinchronichepatitisBpatients[J].JGHOpen,2021,5(2):258-263.
11.FaragMS,FungS,TamE,etal.EffectivenessandRenalSafetyofTenofovirAlafenamideFumarateamongChronicHepatitisBPatients:Real‐WorldStudy[J].JournalofViralHepatitis,2021,28(6):942-950.
12.LoglioA,etal.AASLD2020.Abstract791.
13.AgarwalK,BrunettoM,SetoWK,etal.96weekstreatmentoftenofoviralafenamidevs.tenofovirdisoproxilfumarateforhepatitisBvirusinfection[J].JournalofHepatology,2018,68(4):672-681.
14.TaramassoL,DiBiagioA,RiccardiN,etal.Lipidprofilechangingsafterswitchingfromrilpivirine/tenofovirdisoproxilfumarate/emtricitabinetorilpivirine/tenofoviralafenamide/emtricitabine:Differenteffectsinpatientswithorwithoutbaselinehypercholesterolemia[J].PloSOne,2019,14(10):e0223181.
15.Yanetal.APASL2021,PosterH-36.
16.ZhaoJ,etal.APASL2021,PosterH-2.
-
老刘今年46岁,是一家服装店的老板,半年前的一次体检中,他被检查出了乙肝,从那之后就开始重视起自己的身体健康了,不仅积极地配合医生进行治疗,还十分注重饮食。
老刘认为鸡蛋营养丰富,蛋白质含量也高,每天吃一个鸡蛋有助于病情的好转,就每天吃一个鸡蛋。但最近朋友告诉他,鸡蛋里的胆固醇含量很高,会影响肝脏的代谢,乙肝患者不能吃鸡蛋。他担心自己之前吃的鸡蛋会不会影响肝脏健康,因此,特意来到医院咨询医生。
乙肝患者,每天吃一个鸡蛋会怎样?
鸡蛋物美价廉,是国民喜爱的一种滋补食品。而且,鸡蛋有多种人体所需的氨基酸,不饱和脂肪酸和各种维生素。鸡蛋的蛋白质是众多食物中营养价值最高的,与人体蛋白质氨基酸的模式最为接近,能很好补充肝脏日常运转所需的营养。鸡蛋的胆固醇主要集中在蛋黄中,每颗蛋黄约含200mg的胆固醇,胆固醇会加速脂肪的囤积,给肝细胞带来工作负担,诱发肝炎、肝硬化。但每天一个鸡蛋,并不会诱发高血脂、脂肪肝,原因有以下两点。
1、人体自身也会合成胆固醇,有调节功能
相关研究表明,人体血清胆固醇水平与摄入的食物没有明显的联系,胆固醇是人体运转所必需的物质。当血液中的胆固醇含量较低时,人体就会合成并吸收胆固醇,使其保持在一定浓度。当胆固醇含量过多时,人体就会减少胆固醇的合成与吸收。但是,如果身体大量摄入胆固醇的话,会损害身体的调节功能。
2、鸡蛋中的磷酸酯可以降低胆固醇
鸡蛋中含有的不饱和脂肪酸,可以降低人体内血清胆固醇的含量。蛋黄中含有磷酸酯可以阻止血清胆固醇的沉淀,是一种强乳化剂,可以防止脂肪堆积,堵塞血管,进而减少肝脏受到的损伤。此外,鸡蛋中还含有大量的天然甾醇,对人体十分有益,可以降低患心脑血管疾病的风险。

医生:想要肝好,2个习惯趁早改
1、熬夜俗话说“人卧血归于肝”,夜间是肝脏进行解毒、排毒的黄金时间,此时如果不及时进行休息,就会影响肝脏的代谢,毒素长期累积在肝脏,就会引起肝部炎症,造成肝脏损伤,进而导致肝病不断恶化。因此,对于肝病患者来说,养成一个良好的作息习惯有助于身体健康。

2、酗酒
酒精对人体的损害是非常大的,人体在摄入酒精后,90%需要肝脏来分解,过度饮用,会加重肝脏的负担。酒精对肝细胞有损害作用,存积在肝脏会不断损伤肝细胞,增大肝脏病变的几率。此外,酒精在转化过程中会产生乙醛,这是一种致癌物,长期摄入会增大肝部癌变的风险。
-
大多数慢性乙型肝炎(CHB)患者需要长期甚至终生抗病毒治疗,随着抗病毒治疗方案的不断升级,CHB患者生存期明显延长,患者开始呈现老龄化趋势,合并高血压、糖尿病等基础疾病的比例增加[1],且抗病毒药物也存在一定的肾脏毒性等副作用,以上因素及HBV感染本身的影响,都可能增加CHB患者治疗过程中的骨肾安全性风险[2-3]。
近期我国学者对全国47家医院门诊、2703位经治CHB患者(使用核苷类似物治疗>6个月)开展了一项横断面研究,以评估经治CHB患者的肾脏功能损害相关因素及肾小管损伤高危因素。
研究数据显示,所有患者中57.1%有至少一个肾功能指标异常,14.6%患者合并慢性肾脏病(CKD),提示CHB经治患者的慢性肾损害比例高,尿视黄醇结合蛋白(RBP)、尿β2-微球蛋白、α1-微球蛋白三种肾小管损伤标志物的异常率分别为10.4%、27.1%和18.4%,且患者使用恩替卡韦(ETV)、富马酸替诺福韦酯(TDF)等药物抗病毒治疗时长,与肾小管损伤标志物异常有关[4]。
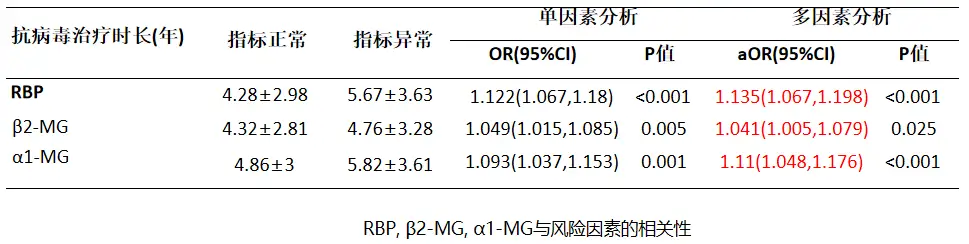
图1 肾小管损伤标志物与抗病毒治疗时长的相关性
一项韩国临床研究数据显示,在102例阿德福韦酯(ADV)耐药、90例ETV耐药患者(无ADV耐药)中,使用TDF进行治疗的,在TDF治疗的五年期间,患者的肾小球滤过率(eGFR)出现进行性下降,股骨密度较基线时也显著下降(-2.48%, p<0.001)[5],提示TDF治疗对患者肾脏功能和骨密度的影响不容忽视。
国内外多个权威CHB指南均将存在或伴有肾功能损伤/骨病高危风险的患者列为“特殊人群”,对抗病毒治疗专门提出推荐意见,例如欧洲肝脏研究协会(EASL)2017版指南就建议,存在骨肾安全性风险的NA初治CHB患者优选丙酚替诺福韦(TAF)或ETV,TDF经治患者应换用TAF或ETV,且先前暴露于NA的患者应优选TAF[4]。
EASL指南的推荐与此后2018版美国肝病研究学会(AASLD)指南推荐相似[5],我国2019年版《慢性乙型肝炎防治指南》对慢性肾脏病患者、肾功能不全或接受肾脏替代治疗的患者推荐ETV或TAF作为一线抗HBV治疗药物,且TAF治疗肾功能不全的患者时,并不需要调整剂量(肌酐清除率<15ml/min且未透析的患者,目前尚无推荐剂量)[6]。
虽然TAF与TDF的前体药物均为替诺福韦,但二者的结构不同,TAF的预磷酸化和磷酰胺酯前药结构,使其能够直达肝脏快速发挥抗病毒作用,同时TAF在血浆中更加稳定,降低了非靶器官的替诺福韦暴露,从而在保障疗效的同时改善了骨肾安全性。
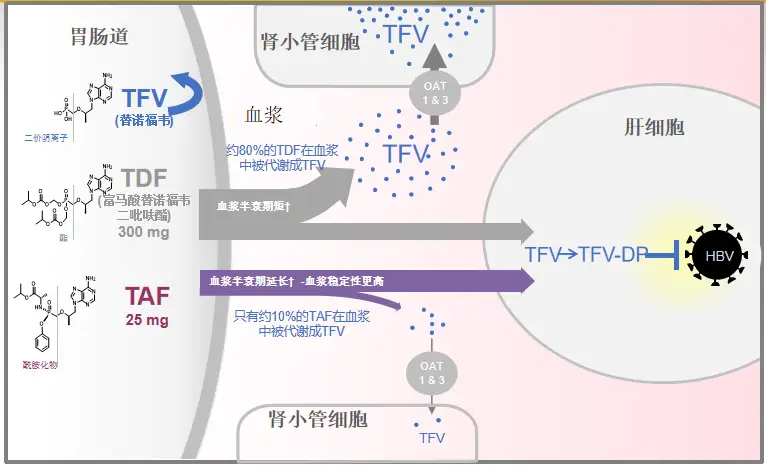
图2 TAF精准靶向肝脏,降低骨肾风险
2020年AASLD年会公布了TAF两项核心临床III期研究108 & 110研究的5年随访数据,TAF治疗5年后患者eGFR仅有轻微下降(见图3),且TDF经治患者换用TAF治疗后,eGFR及β2微球蛋白:尿肌酐值(β2M:Cr)等近端肾小管标志物水平均较换用TAF前有所上升;TAF治疗组的髋/脊柱骨密度相对保持稳定,而TDF经治患者换用TAF后,髋/脊柱骨密度平均百分比增加(见图4),都支持了TAF治疗良好的骨肾安全性[7]。
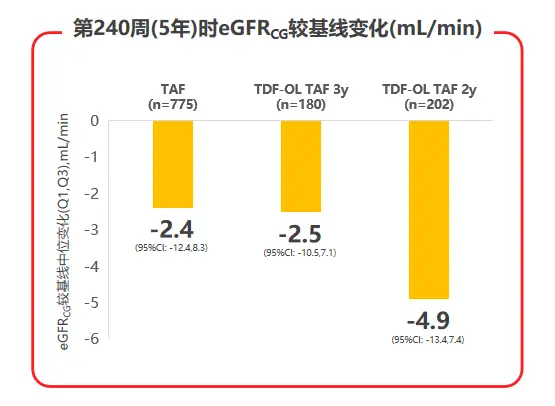
图3 108 & 110研究治疗240周时eGFR变化情况
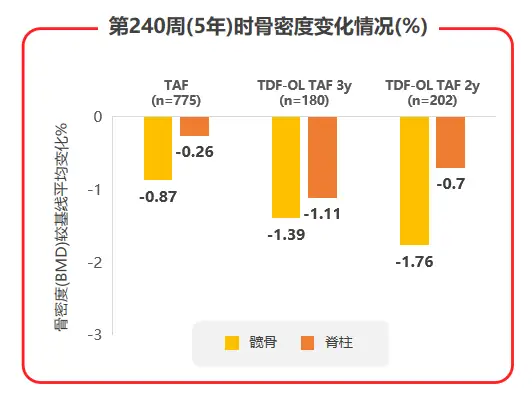
图4 108 & 110研究中治疗240周时骨密度变化情况
2020年EASL年会则公布了TAF临床II期4035研究数据,在治疗伴有肾功能损伤,且TDF或其它NAs经治已获得病毒学应答CHB患者的研究队列A中,患者换用TAF后仍能维持病毒学抑制和ALT正常的状态,且肌酐清除率、血肌酐、血磷水平,RBP:Cr、β2M:Cr等近端肾小管功能标志物水平均维持稳定,髋/脊柱骨密度小幅上升,提示TAF治疗的骨肾安全性良好[8]。
以上临床证据均显示,CHB患者的骨肾安全性风险应得到高度重视,而存在风险或已有肾功能损伤/骨病的患者,无论是初治还是经治,均应按照指南推荐将TAF作为治疗优选方案,从而实现疗效和安全性两方面的获益。
参考文献:
1. Wong G L, Wong V W, Yuen B W, et al. An Aging Population of Chronic Hepatitis B With Increasing Comorbidities: A Territory-Wide Study From 2000 to 2017.[J]. Hepatology, 2020, 71(2): 444-455.
2. Shin J, Kwon H J, Jang H R, et al. Risk factors for renal functional decline in chronic hepatitis B patients receiving oral antiviral agents[J]. Medicine, 2016, 95(1).
3. Biver E, Calmy A, Rizzoli R. Bone health in HIV and hepatitis B or C infections[J]. Therapeutic Advances in Musculoskeletal Disease, 2017, 9(1): 22-34.
4.刘静, 肖光明, 吕芳芳, 等. 一项中国慢性乙型肝炎门诊经治患者肾脏功能损害的横断面研究
5. Lim Y S, Gwak G Y, Choi J, et al. Monotherapy with tenofovir disoproxil fumarate for adefovir-resistant vs. entecavir-resistant chronic hepatitis B: a 5-year clinical trial[J]. Journal of Hepatology, 2019, 71(1): 35-44.
6. European Association For The Study Of The Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection[J]. Journal of Hepatology, 2017, 67(2): 370-398.
7. Terrault N A, Lok A S F, McMahon B J, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599.
8. 中华医学会感染病学分会,中华医学会肝病学分会.慢性乙型肝炎防治指南(2019年版)[J].实用肝脏病杂志,2020,23(1):后插9-后插32.
9. Chan HL, et al. Poster 803 Maintenance of High Levels of Viral Suppression and Improved Safety Profile of Tenofovir Alafenamide (TAF) Relative to Tenofovir Disoproxil Fumarate (TDF) in Chronic Hepatitis B Patients Treated for 5 Years in 2 Ongoing Phase 3 Studies[J]. Hepatology, 2020, 72(S1): 131A-1159A.
10. Lim Y-S, Lin C-Y, Heo J, et al. SAT442 - Safety and efficacy of switching to tenofovir alafenamide (TAF) in virally suppressed chronic hepatitis B (CHB) patients with hepatic impairment: week 48 results from a phase 2 open label study[J]. Journal of Hepatology, 2020, 73(S1): S872. -
为实现慢性乙型肝炎(CHB)治疗中,“HBV DNA降得越低越好”的治疗目标,近年来国内外权威指南纷纷调整一线治疗推荐,推荐丙酚替诺福韦(TAF)等多种强效低耐药药物[1-2]。凭借良好的抗病毒效果和骨肾安全性,TAF获得我国越来越多临床医师的青睐。
在2020年美国肝病研究学会(AASLD)年会上,TAF治疗CHB的两项核心临床III期研究——108 & 110研究5年随访数据公布[3],TAF维持了此前持续强效抗病毒、骨肾安全性良好的整体表现,为其在我国CHB治疗中的进一步广泛应用提供了力证。
108 & 110两项临床III期研究,均为国际多中心、双盲、随机对照临床试验,本次分析共纳入1248名CHB患者(纳入标准为:HBV DNA≥20000 IU/mL,男性ALT>60 U/L,女性ALT>38 U/L,eGFRCG≥50 mL/min,近期影像学检查无肝细胞癌(HCC)证据),入组患者按2:1比例分入TAF组(n=866)或TDF组(n=382),其中TDF组患者180例在第96周、202例在第144周后开放标签,换用TAF进行治疗(见图1)。
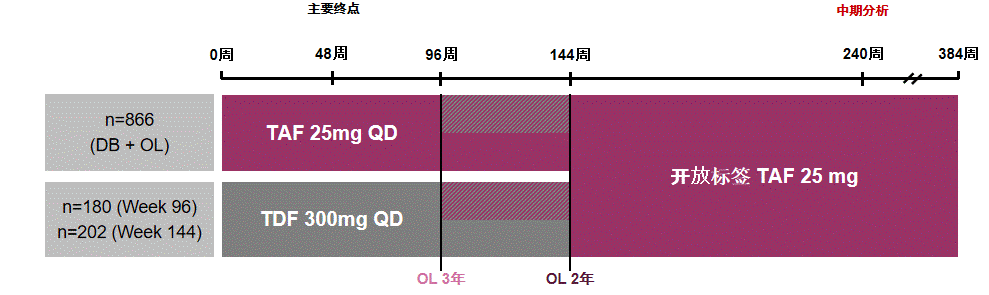
图1 108 & 110研究整体设计
不同治疗组患者整体基线特征如图2所示,可看出研究入组患者有着同时覆盖初治及经治患者(核苷(酸)类似物经治患者约占25%)、亚裔比例较高(TAF组中比例79%)、病毒载量均值高(平均值为7 log10IU/mL)和ALT水平高(96%患者ALT超过正常参考值上限/ULN一倍以上)的特点。
2019年我国《慢性乙型肝炎防治指南》扩大CHB患者启动治疗的适应证,将HBV DNA阳性、ALT持续异常(ALT>ULN)且排除其它原因导致ALT升高的慢性HBV携带者纳入抗病毒治疗范围,108 & 110研究人群整体特征与这一适应证对应患者群体相似。
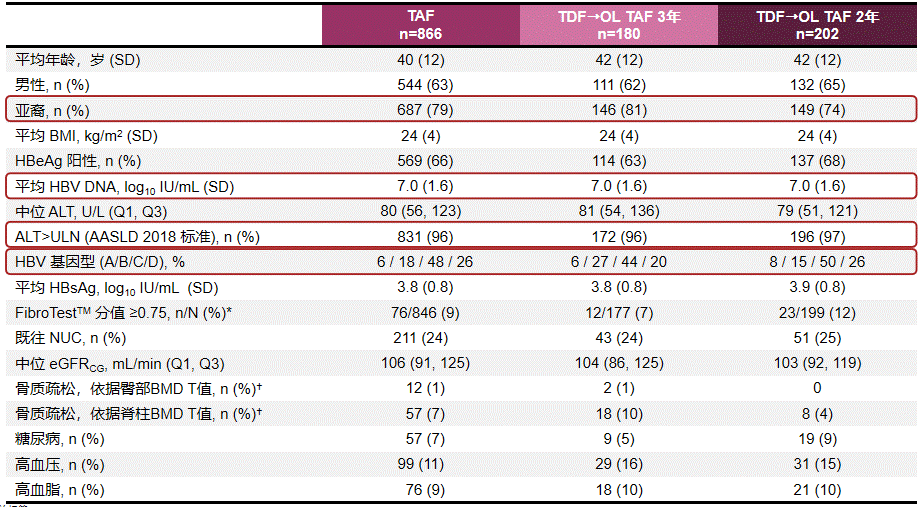
图2 108 & 110研究患者基线特征
两项研究5年分析时的有效性终点为治疗240周的病毒学抑制率(定义病毒抑制为HBV DNA<29 IU/mL),其它有效性终点则包括研究过程中持续评估的ALT复常率、血清学应答、肝纤维化变化、基因型耐药等指标。研究的安全性终点包括不良事件(AEs),LDL-C、淀粉酶升高等实验室检查结果异常,以及各项骨肾安全性标志物的变化。
在有效性终点方面,TAF治疗组的5年病毒学抑制率为93%,TDF换用TAF治疗2年或3年的患者病毒学抑制率分别为96%和92%,TAF治疗均实现并维持相似的高病毒学抑制率。
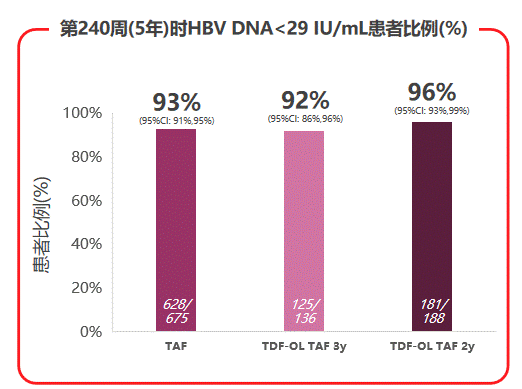
图3 108 & 110研究病毒学抑制状况
按照2018年AASLD最新ALT正常标准(男性患者≤35 U/L,女性患者≤25 U/L)评价,TAF治疗组、换用TAF两年/三年的三组患者,ALT复常率分别为76%、76%和74%,提示ALT治疗可维持CHB患者较高的ALT复常率。
AASLD年会同期公布了108 & 110研究一项亚组分析,该分析共纳入1632名CHB患者,评估患者基线HBV DNA载量对治疗过程中ALT复常的影响,分析结果显示TAF组患者的ALT复常率不受基线HBV DNA载量影响,且对基线低、中、高病毒载量患者,TAF治疗的ALT复常率均高于TDF(见图4)[4]。
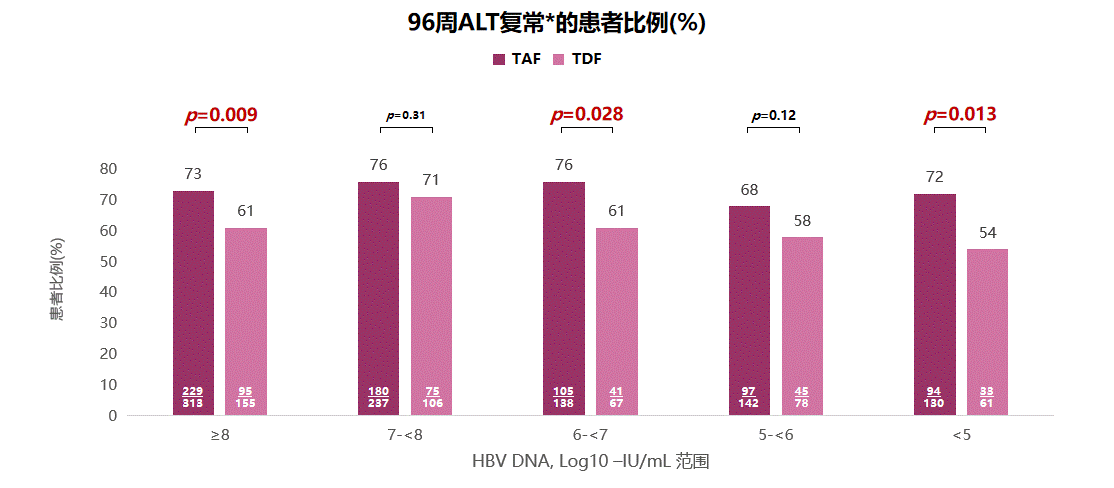
图4 108 & 110研究中基线病毒载量不同患者的ALT复常比例
血清学应答方面,TAF或TDF治疗患者5年内的HBsAg消失率均较低(共5例),但HBeAg消失/血清学转换率逐年增加(见图5),FibroTest检查结果显示,大多数患者的肝纤维化维持稳定或有所改善,肝纤维化加重比例约为10%。5年分析报告的随访240周期间,未观察到基因型耐药(表型耐药结果待定),TAF治疗相关耐药的发生率仍然为0.
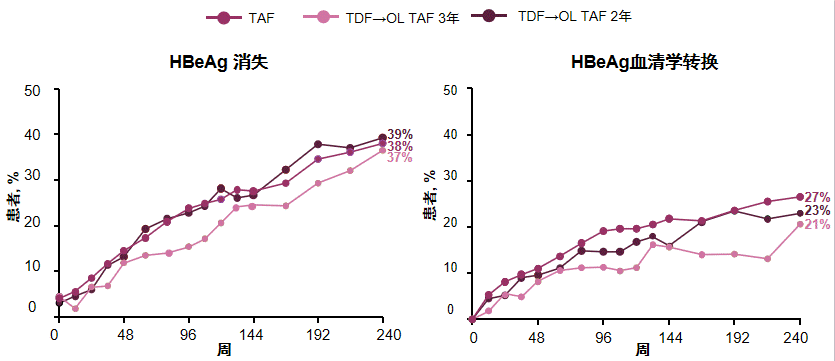
图5 108 & 110研究的HBeag消失/血清学转换情况
在治疗安全性方面,三个治疗组的不良事件和实验室检查结果异常发生率接近,3-4级不良事件或严重不良事件发生率低,因不良事件停药患者不足1%。肾脏安全性指标显示,TAF治疗5年后患者估算肾小球滤过率(eGFRCG)仅有轻微下降,且TDF经治患者换用TAF治疗后,eGFRCG(见图6)及β2微球蛋白:尿肌酐值(β2M:Cr)等近端肾小管标志物水平,均较换用TAF前有所上升,提示TAF治疗较好的肾脏安全性。
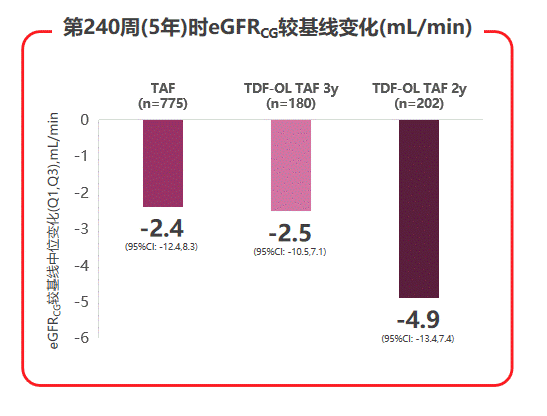
图6 108 & 110研究中患者eGFRCG变化状况
而在骨安全性方面,TAF治疗组的髋/脊柱骨密度相对保持稳定,TDF经治患者换用TAF后,髋/脊柱骨密度平均百分比增加(见图7),提示换用TAF可能改善TDF治疗导致的骨流失。综合不良事件、实验室检查结果异常发生率和骨肾安全性数据,TAF在强效抑制病毒、耐药仍然为0的基础上,安全性也令人满意。
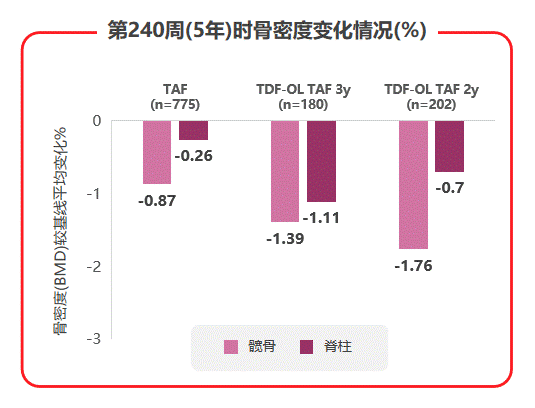
图7 108 & 110研究中患者髋/脊柱骨密度治疗5年间变化情况
总结
108 & 110研究的5年分析数据,实现了有效性和安全性的双优,为TAF长期使用提供了重要循证医学证据。而AASLD年会上公布的多项真实世界研究[5-6],也反映出TAF作为目前国内外指南力推荐治疗用药,已经开始全方位深入CHB治疗,用于情况不同的各种实战环境,相信未来还会有更多反映TAF优势的临床应用数据。
参考文献:
1. 中华医学会感染病学分会,中华医学会肝病学分会.慢性乙型肝炎防治指南(2019年版)[J].实用肝脏病杂志,2020,23(1):后插9-后插32.
2. Terrault N A, Lok A S F, McMahon B J, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599.
3. Chan HL, et al. AASLD 2020. Abstract 803.
4. Lim Y-S, et al. AASLD 2020. Abstract 796.
5. Zhang YQ, et al. AASLD 2020. Abstract 779.
6. Zhang YQ, et al. AASLD 2020. Abstract 780. -
丙酚替诺福韦(TAF)作为强效低耐药的核苷酸类似物药物 ,在慢性乙型肝炎(CHB)中的治疗价值已得到高度认可,但随着抗病毒治疗效果的改善,CHB治疗中也出现了一些需要应对的新问题,如对慢性非传染性疾病较多的老年患者、肝/肾功能损伤患者等群体,抗病毒方案的选择就需要细化。近年来多项临床研究已显示,TAF用于CHB多种不同患者人群有着良好的有效性和安全性[1-2],而各种真实世界研究进一步证实了TAF的治疗价值,本文将对多项相关研究进行解读。
低病毒血症患者改用TAF,可改善病毒学应答状况
对经治且存在低病毒血症(LLV,美国AASLD指南定义为HBV DNA20~2000 IU/mL[3])的患者,换用TAF治疗有望提升完全病毒学应答(CVR)比例。如日本多中心、回顾性KULDS研究,共入组313例≥20岁,治疗至少2年的经治CHB患者,其中191例接受恩替卡韦(ETV)治疗,122例接受其他核苷(酸)类似物(NA)联合治疗治疗。
研究评估患者换用TAF治疗48周时的疗效及肾脏安全性,其中ETV经治患者基线有34例LLV患者,换用TAF治疗48周后33例达到CVR(HBV DNA≤20 IU/mL),比例高达97.1%;基于TDF或ADV的NA联合治疗组基线有9例LLV患者,换用TAF治疗后也有7例达到CVR[4]。
我国学者开展的一项前瞻性、单中心真实世界研究[5],共入组211例ETV单药治疗≥48周后为LLV的CHB患者,按患者意愿继续ETV单药治疗(109例)或换用TAF(102例),评价治疗24周时的CVR(HBV DNA <20 IU/mL)比例,次要终点包括HBV DNA下降程度及ALT 复常率,安全性终点包括治疗不良事件、肾功能变化等,其中150例患者纳入倾向性评分匹配(PSM)队列,继续ETV治疗和换用TAF的患者各有75例,组间基线特征整体相近。
不论是在PSM队列还是在原始队列(RAW队列)中,治疗12、24周时换用TAF组患者的CVR比例(见图1)均显著高于ETV单药治疗组;治疗24周时在PSM队列中,换用TAF患者HBV DNA定量平均降幅为1.99 log10 IU/ml,显著高于ETV组的0.76 log10 IU/ml(p=0.002),RAW队列中降幅则分别为2.2 log10 IU/ml和0.74 log10 IU/ml,TAF组降幅仍显著更高(p<0.001)。
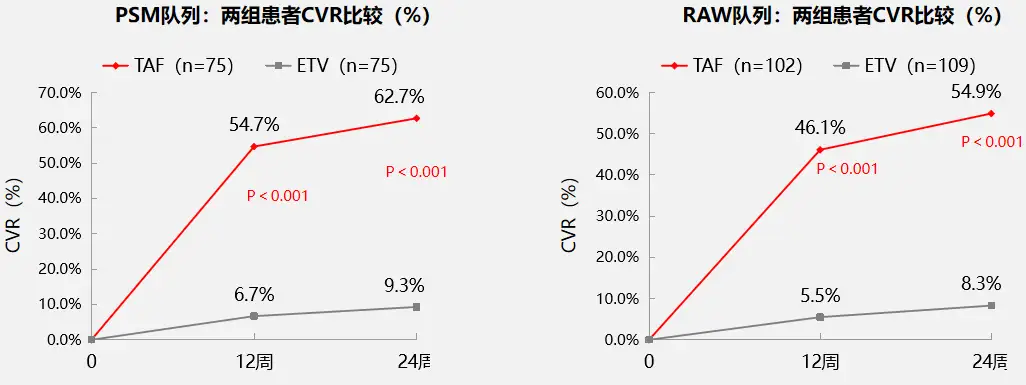
图1 两组LLV患者CVR情况比较
按中心实验室标准或2018年AASLD标准评价的ALT复常率,至24周时不论是PSM队列还是RAW队列,TAF组均显著高于ETV组(见图2,12周时PSM队列TAF组的ALT复常率数值上更高,但差异尚未达到统计学显著性),但无论在PSM或RAW队列中,两组患者HBeAg转阴率/血清转换率、qHBsAg变化等HBV生物标志物变化,肝硬度测量等无创性肝纤维化测量结果均无显著差异。
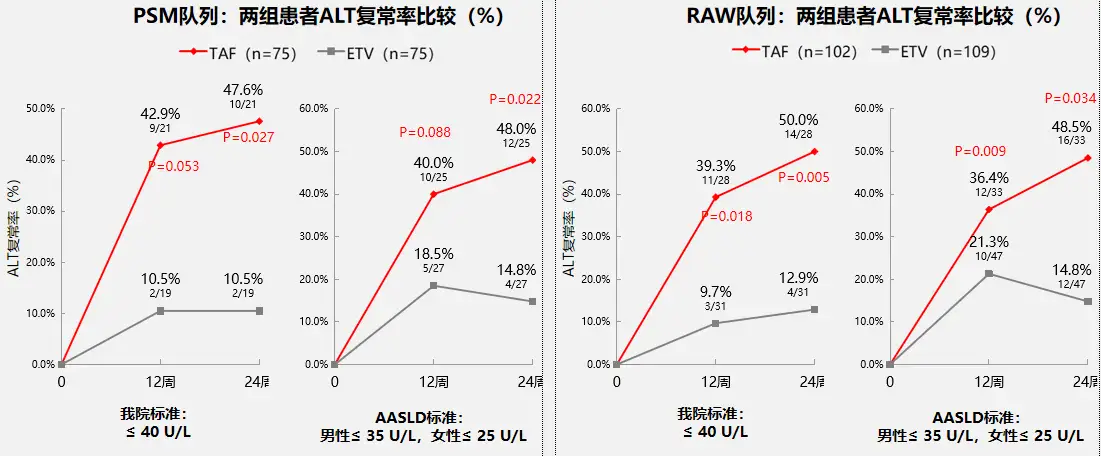
图2 两组患者ALT复常率比较
安全性终点方面数据显示,换用TAF组与继续ETV单药治疗耐受性均较好,两组不良事件、严重不良事件和实验室指标异常的发生率相似,且绝大部分不良事件均为轻中度,在整个随访期间两组均无患者因不良事件而停药,PSM队列中治疗24周时,两组平均估算肾小球滤过率(eGFR)下降程度无显著差异(1.1%/1.5%,p=0.707)。这项研究数据为ETV治疗后出现LLV的患者,换用TAF治疗提供了疗效和安全性证据。
其它NA应答不佳患者 ,换用TAF可实现良好病毒学应答
虽然近年来在CHB抗病毒治疗中,TAF等高耐药屏障药物已经成为主要选择,但我国曾广泛应用LAM等低耐药屏障药物,多项HBV耐药监测研究显示,我国经治CHB患者中约40%存在耐药相关突变,其中LAM耐药相关位点最为常见[6-7],且ETV与LAM等药物存在交叉耐药。而目前尚未发现TAF存在与其它NAs的交叉耐药,因此对存在LAM、ETV等药物耐药位点,其它NAs治疗应答不佳的患者,使用TAF可能是较好的治疗选择。
2020年AASLD年会上发表的一项日本前瞻性真实世界研究[8],共纳入38例其它NAs应答不佳(定义为病毒学突破,即HBV DNA相对最低值上升≥1 log10 IU/mL和/或NAs经治超过1年HBV DNA仍≥2 log10 IU/ml,维持不完全病毒学抑制)的CHB患者,评估换用TAF治疗1年后的病毒学应答(HBV DNA <10 IU/mL)情况,并根据患者基因型耐药位点,对疗效进行分层分析。
7例此前接受过TDF治疗的患者,仅2例(28.6%)接受TAF治疗后达到病毒学应答;31例此前治疗方案不含TDF的患者,换用TAF治疗后25例(80.6%)达到病毒学应答(p=0.014),根据耐药位点进行的分层分析如图[YL27] 3所示,基线高HBV DNA[YL28] [V29] 水平(≥4.3 log10 IU/ml)且[YL30] HBeAg阳性和对TDF应答不佳,[YL31] 与换用TAF治疗病毒学应答比例较低有关。因此对其它NAs应答不佳,尤其是LAM/ETV耐药的难治患者,换用TAF可取得良好的病毒学应答。
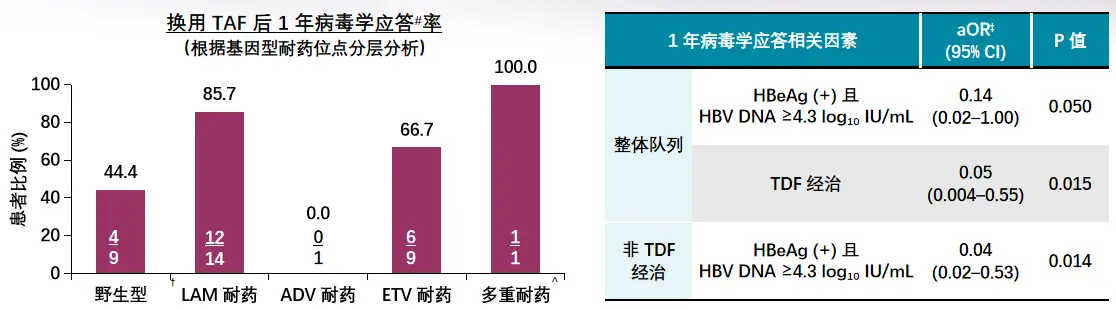
图3 其它NAs应答不佳患者换用TAF治疗后的病毒学应答情况
经治患者换用TAF,短期和长期数据均提示肾脏安全性改善
上文列举的多项经治CHB患者换用TAF真实世界研究,大多对eGFR等肾功能指标进行过分析,评价TAF治疗的肾脏安全性,还有一些真实世界研究则专门从这一角度出发,评价CHB患者换用TAF后,肾功能指标、近端肾小管标志物的变化情况。
例如一项入组72例TDF经治CHB患者的单中心、前瞻性真实世界研究显示,患者换用TAF治疗24周后,近端肾小管标志物水平即显著下降,β2M:Cr比值从基线时的1.5降至1.1(p<0.01)、视黄醇结合蛋白(RBP):Cr比值从基线时的1.7降至1.4(P<0.01)[9],治疗72周时两种标志物仍维持较基线时显著下降的状态(P<0.01),且仅有两例CKD2期患者进展至3期,提示患者整体肾功能维持较好[10]。
一项加拿大真实世界研究[11]共纳入176例基线eGFR为60-90 mL/min/1.73㎡,即已存在轻度肾功能损伤,且使用TAF治疗的CHB患者,其中126例(73%)为TDF换用TAF,43例(25%)为其它NAs换用TAF,其余为初治CHB患者 ,随访评估TAF治疗期间(最长随访160周)的肾功能指标变化情况。
研究数据显示,患者此前在TDF治疗期间,eGFR每月平均下降0.18 mL/min/1.73㎡(p=0.008),但换用TAF治疗后 ,eGFR指标维持稳定(±0.00 mL/min/1.73㎡,p=0.02,见图13),血磷也有改善趋势(TAF治疗后上升1.0 log10 IU/mL,p=0.2),提示从TDF换用TAF后患者肾功能指标有改善趋势。
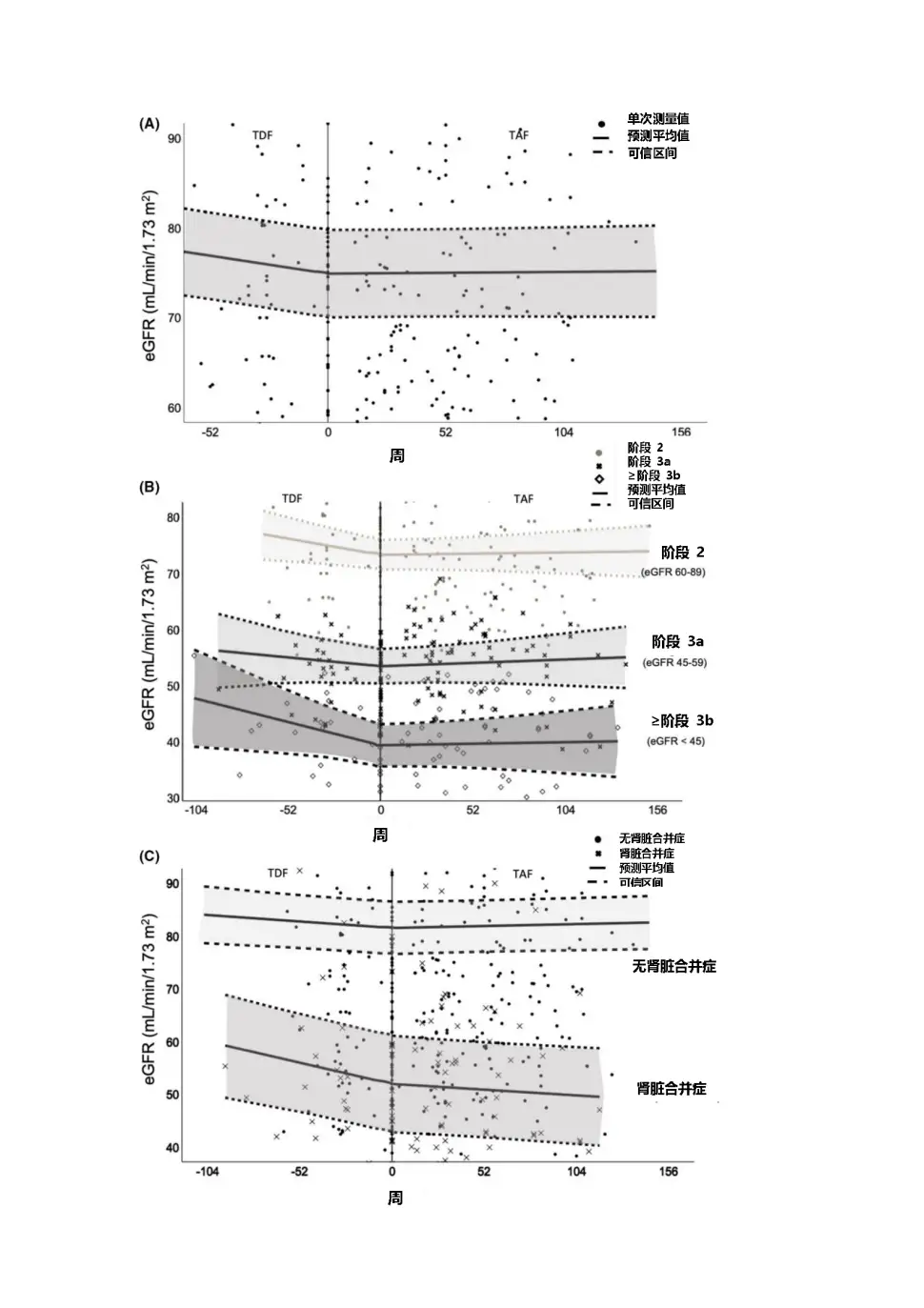
图4 患者换用TAF前后的eGFR指标变化情况
2020年AASLD年会上一项意大利前瞻性、真实世界研究[12],评价了从TDF±ADV换用TAF治疗后,患者近端肾小管标志物的早期变化,研究共入组146例TDF经治CHB患者 ,基线特征如表1所示,患者主要因符合2017年EASL指南中年龄或骨肾风险标准而换用TAF治疗。
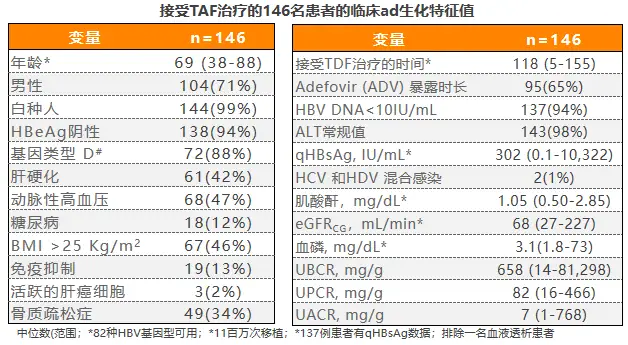
表1 患者基线特征情况
患者换用TAF治疗6个月时,病毒学应答率维持稳定,ALT无明显变化,无患者因治疗不良事件停药。换用TAF治疗2个月后,患者β2M:Cr由基线时的658mg/g降至433mg/g,治疗6个月时进一步降至315mg/g;77例基线β2M:Cr异常患者中,24例在6个月时复常;此外患者尿蛋白/肌酐比(UPCR)整体明显下降,MDRD公式估算的eGFR维持稳定,提示换用TAF后肾功能保持良好,换用TAF能快速改善近端肾小管功能(见表2)。

表2 患者病毒学与生化特征指标变化情况
换用TAF治疗对血脂影响小,合并糖尿病的患者用药安全性良好
在TAF的关键临床研究108/110中,患者由TDF转换为TAF治疗时,会出现总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)等血脂指标的小幅上升[13], 但有研究认为其原因是TDF治疗导致的血脂下降,并不能认为TAF有“升高患者血脂”,甚至增加心血管风险的作用[14]。
2021年亚太肝病研究学会(APASL)年会上,两项来自中国的真实世界研究提供了TAF治疗对CHB患者血脂水平影响的最新数据,第一项单中心、回顾性队列研究[15]共纳入499例ETV单药治疗≥12个月,且应答不佳(定义为HBV DNA水平30-2000 IU/mL)的CHB患者,其中104例换用TAF治疗,剩余患者继续使用ETV,两组患者除年龄外的基线特征无显著差异 ,研究评价治疗24周时治疗的病毒学、生化学应答和患者血脂变化情况。
由ETV转换为TAF治疗24周后,79.4%患者达到病毒学应答(HBV DNA <30 IU/mL),显著优于继续使用ETV组的9.1%(p<0.001);TAF治疗组24周时ALT正常(<40 U/L)比例为92.6%,显著优于ETV组的80.6%(p=0.014),提示换用TAF后治疗生化学应答有所改善。而对换用TAF治疗组中31例患者进行的血脂水平分析显示,治疗24周时患者TC、TG、LDL-C、HDL-C水平较基线时无显著变化(见表3)。
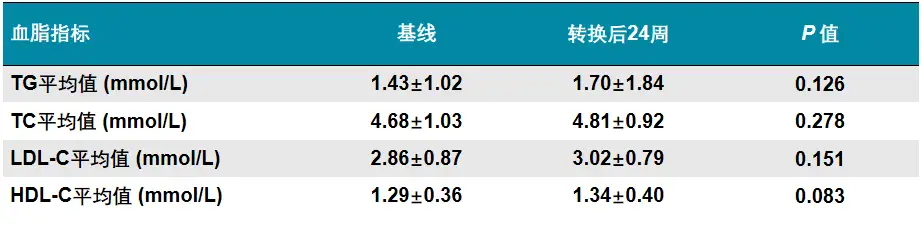
表3 ETV治疗应答不佳患者换用TAF后血脂变化
另一项我国单中心真实世界研究[16],则评价了TAF用于合并糖尿病CHB患者的血脂水平变化情况,入组的34例患者中有28例为其它NA经治患者。换用TAF治疗24周时的血脂指标显示,患者TC、TG、LDL-C、HDL-C水平及TC/HDL比值较基线时无显著变化(见表4),且初治CHB患者、由TDF换用TAF患者、由ETV换用TAF患者亚组结论与整体人群相似 。此研究结果显示TAF用于慢性肾脏病风险相对较高的糖尿病患者,不会显著影响血脂水平。
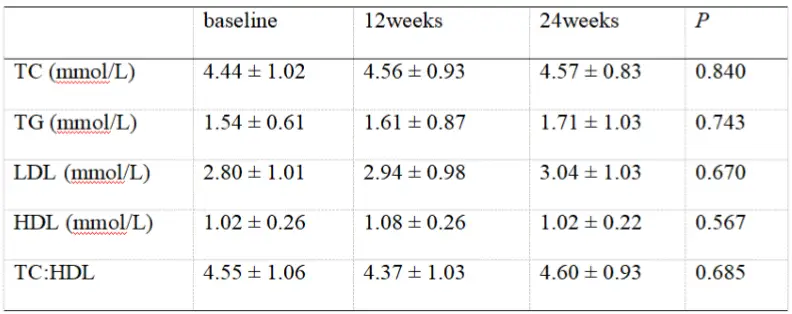
表4 TAF治疗合并糖尿病CHB患者24周时的血脂变化
结语
用于LLV患者、其它NAs应答不佳患者等临床情况状况各异的人群时,TAF治疗都体现了良好的抗病毒效果和肾脏安全性,这为TAF成为多种不同患者人群的优选治疗方案提供了重要依据,对临床实践也有很大的参考意义。未来随着TAF治疗的数据和经验不断积累,还会有更多真实世界研究提供更全面、细致的信息,更好地指导TAF的临床应用。
参考文献:
1. Janssen H L A, et al. EASL 2021, Abstract PO-2395.
2. Lim Y S, et al. EASL 2021, Abstract PO-2338.
3. Terrault N A, Lok A S F, McMahon B J, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599.
4. Ogawa E, Nomura H, Nakamuta M, et al. Tenofovir alafenamide after switching from entecavir or nucleos (t) ide combination therapy for patients with chronic hepatitis B[J]. Liver International, 2020, 40(7): 1578-1589.
5. Li Z B, Li L, Niu X X, et al. Switching from entecavir to tenofovir alafenamide for chronic hepatitis B patients with low‐level viraemia[J]. Liver International, 2021, 41(6): 1254-1264.
6. Li X, Liu Y, Xin S, et al. Comparison of detection rate and mutational pattern of drug-resistant mutations between a large cohort of genotype B and genotype C hepatitis B virus-infected patients in North China[J]. Microbial Drug Resistance, 2017, 23(4): 516-522.
7. Guo X, Wu J, Wei F, et al. Trends in hepatitis B virus resistance to nucleoside/nucleotide analogues in North China from 2009–2016: a retrospective study[J]. International Journal of Antimicrobial Agents, 2018, 52(2): 201-209.
8. Hosaka T, et al. AASLD 2020, Abstract 817.
9. Fong T L, et al. DDW 2018, Abstract Sa1499.
10. Lee B T, Chang M, Lim C, et al. Bone and renal safety profile at 72 weeks after switching to tenofovir alafenamide in chronic hepatitis B patients[J]. JGH Open, 2021, 5(2): 258-263.
11. Farag M S, Fung S, Tam E, et al. Effectiveness and Renal Safety of Tenofovir Alafenamide Fumarate among Chronic Hepatitis B Patients: Real‐World Study[J]. Journal of Viral Hepatitis, 2021, 28(6): 942-950.
12. Loglio A, et al. AASLD 2020. Abstract 791.
13. Agarwal K, Brunetto M, Seto W K, et al. 96 weeks treatment of tenofovir alafenamide vs. tenofovir disoproxil fumarate for hepatitis B virus infection[J]. Journal of Hepatology, 2018, 68(4): 672-681.
14. Taramasso L, Di Biagio A, Riccardi N, et al. Lipid profile changings after switching from rilpivirine/tenofovir disoproxil fumarate/emtricitabine to rilpivirine/tenofovir alafenamide/emtricitabine: Different effects in patients with or without baseline hypercholesterolemia[J]. PloS One, 2019, 14(10): e0223181.
15. Yan et al. APASL 2021, Poster H-36.
16. Zhao J, et al. APASL 2021, Poster H-2. -
大多数慢性乙型肝炎(CHB)患者需要长期甚至终生抗病毒治疗,随着抗病毒治疗方案的不断升级,CHB患者生存期明显延长,患者开始呈现老龄化趋势,合并高血压、糖尿病等基础疾病的比例增加[1],且抗病毒药物也存在一定的肾脏毒性等副作用,以上因素及HBV感染本身的影响,都可能增加CHB患者治疗过程中的骨肾安全性风险[2-3]。
近期我国学者对全国47家医院门诊、2703位经治CHB患者(使用核苷类似物治疗>6个月)开展了一项横断面研究,以评估经治CHB患者的肾脏功能损害相关因素及肾小管损伤高危因素。
研究数据显示,所有患者中57.1%有至少一个肾功能指标异常,14.6%患者合并慢性肾脏病(CKD),提示CHB经治患者的慢性肾损害比例高,尿视黄醇结合蛋白(RBP)、尿β2-微球蛋白、α1-微球蛋白三种肾小管损伤标志物的异常率分别为10.4%、27.1%和18.4%,且患者使用恩替卡韦(ETV)、富马酸替诺福韦酯(TDF)等药物抗病毒治疗时长,与肾小管损伤标志物异常有关[4]。
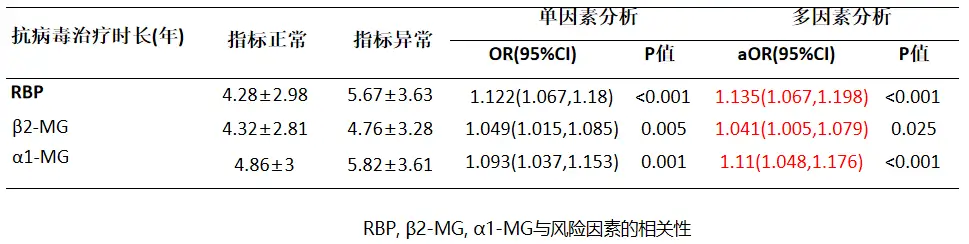
图1 肾小管损伤标志物与抗病毒治疗时长的相关性
一项韩国临床研究数据显示,在102例阿德福韦酯(ADV)耐药、90例ETV耐药患者(无ADV耐药)中,使用TDF进行治疗的,在TDF治疗的五年期间,患者的肾小球滤过率(eGFR)出现进行性下降,股骨密度较基线时也显著下降(-2.48%, p<0.001)[5],提示TDF治疗对患者肾脏功能和骨密度的影响不容忽视。
国内外多个权威CHB指南均将存在或伴有肾功能损伤/骨病高危风险的患者列为“特殊人群”,对抗病毒治疗专门提出推荐意见,例如欧洲肝脏研究协会(EASL)2017版指南就建议,存在骨肾安全性风险的NA初治CHB患者优选丙酚替诺福韦(TAF)或ETV,TDF经治患者应换用TAF或ETV,且先前暴露于NA的患者应优选TAF[4]。
EASL指南的推荐与此后2018版美国肝病研究学会(AASLD)指南推荐相似[5],我国2019年版《慢性乙型肝炎防治指南》对慢性肾脏病患者、肾功能不全或接受肾脏替代治疗的患者推荐ETV或TAF作为一线抗HBV治疗药物,且TAF治疗肾功能不全的患者时,并不需要调整剂量(肌酐清除率<15ml/min且未透析的患者,目前尚无推荐剂量)[6]。
虽然TAF与TDF的前体药物均为替诺福韦,但二者的结构不同,TAF的预磷酸化和磷酰胺酯前药结构,使其能够直达肝脏快速发挥抗病毒作用,同时TAF在血浆中更加稳定,降低了非靶器官的替诺福韦暴露,从而在保障疗效的同时改善了骨肾安全性。
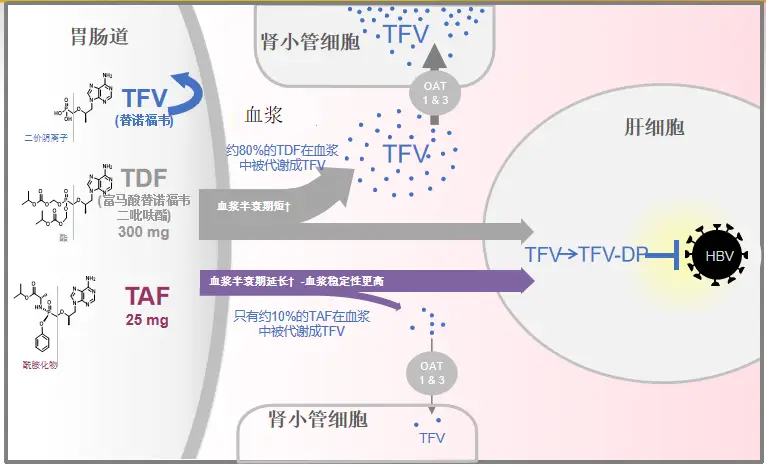
图2 TAF精准靶向肝脏,降低骨肾风险
2020年AASLD年会公布了TAF两项核心临床III期研究108 & 110研究的5年随访数据,TAF治疗5年后患者eGFR仅有轻微下降(见图3),且TDF经治患者换用TAF治疗后,eGFR及β2微球蛋白:尿肌酐值(β2M:Cr)等近端肾小管标志物水平均较换用TAF前有所上升;TAF治疗组的髋/脊柱骨密度相对保持稳定,而TDF经治患者换用TAF后,髋/脊柱骨密度平均百分比增加(见图4),都支持了TAF治疗良好的骨肾安全性[7]。
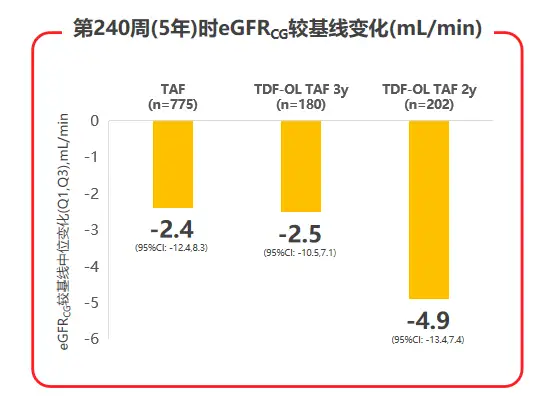
图3 108 & 110研究治疗240周时eGFR变化情况
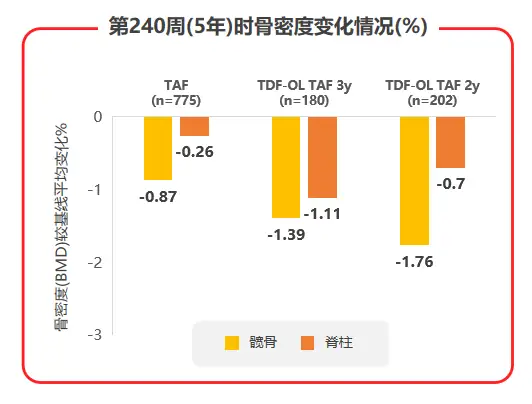
图4 108 & 110研究中治疗240周时骨密度变化情况
2020年EASL年会则公布了TAF临床II期4035研究数据,在治疗伴有肾功能损伤,且TDF或其它NAs经治已获得病毒学应答CHB患者的研究队列A中,患者换用TAF后仍能维持病毒学抑制和ALT正常的状态,且肌酐清除率、血肌酐、血磷水平,RBP:Cr、β2M:Cr等近端肾小管功能标志物水平均维持稳定,髋/脊柱骨密度小幅上升,提示TAF治疗的骨肾安全性良好[8]。
以上临床证据均显示,CHB患者的骨肾安全性风险应得到高度重视,而存在风险或已有肾功能损伤/骨病的患者,无论是初治还是经治,均应按照指南推荐将TAF作为治疗优选方案,从而实现疗效和安全性两方面的获益。
参考文献:
1. Wong G L, Wong V W, Yuen B W, et al. An Aging Population of Chronic Hepatitis B With Increasing Comorbidities: A Territory-Wide Study From 2000 to 2017.[J]. Hepatology, 2020, 71(2): 444-455.
2. Shin J, Kwon H J, Jang H R, et al. Risk factors for renal functional decline in chronic hepatitis B patients receiving oral antiviral agents[J]. Medicine, 2016, 95(1).
3. Biver E, Calmy A, Rizzoli R. Bone health in HIV and hepatitis B or C infections[J]. Therapeutic Advances in Musculoskeletal Disease, 2017, 9(1): 22-34.
4.刘静, 肖光明, 吕芳芳, 等. 一项中国慢性乙型肝炎门诊经治患者肾脏功能损害的横断面研究
5. Lim Y S, Gwak G Y, Choi J, et al. Monotherapy with tenofovir disoproxil fumarate for adefovir-resistant vs. entecavir-resistant chronic hepatitis B: a 5-year clinical trial[J]. Journal of Hepatology, 2019, 71(1): 35-44.
6. European Association For The Study Of The Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection[J]. Journal of Hepatology, 2017, 67(2): 370-398.
7. Terrault N A, Lok A S F, McMahon B J, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599.
8. 中华医学会感染病学分会,中华医学会肝病学分会.慢性乙型肝炎防治指南(2019年版)[J].实用肝脏病杂志,2020,23(1):后插9-后插32.
9. Chan HL, et al. Poster 803 Maintenance of High Levels of Viral Suppression and Improved Safety Profile of Tenofovir Alafenamide (TAF) Relative to Tenofovir Disoproxil Fumarate (TDF) in Chronic Hepatitis B Patients Treated for 5 Years in 2 Ongoing Phase 3 Studies[J]. Hepatology, 2020, 72(S1): 131A-1159A.
10. Lim Y-S, Lin C-Y, Heo J, et al. SAT442 - Safety and efficacy of switching to tenofovir alafenamide (TAF) in virally suppressed chronic hepatitis B (CHB) patients with hepatic impairment: week 48 results from a phase 2 open label study[J]. Journal of Hepatology, 2020, 73(S1): S872.
-



杨松,医学博士,副主任医师,北京大学副教授,北京肝病学会青委会副主任委员,主持我国16部肝病指南共识文件撰写。
点击跟医生交流→ https://m.healthjd.com/s/EvaluationManage/DoctorDetail?doctorId=194110237171
图片来源于网络,如有侵权请联系删除。
-
现在早产儿出生并不少见,而且宝宝体重太小,可以想象对后期的成长有多大的影响。早产现象给婴儿健康带来了严重威胁。随着婴儿到来的喜悦,准妈妈们是否警惕早产的威胁?早产儿要注意预防并发症,那么如何预防呢?
造成早产的原因:
一、胎儿
双胞胎,多胞胎,羊水过多,胎儿畸形,胎盘异常,如前置胎盘,胎盘早剥,胎盘功能障碍等。
二、妈妈
孕期妇女感染急性传染病、慢性病、严重贫血症等,易出现早产。此外,孕妇营养不良,尤其是缺乏蛋白质和维生素E,缺乏叶酸,也是导致早产的原因之一。此外孕期性生活不适当,活动过度,携带物品过多也会导致早产。

三、年龄
18岁以下或35岁以上的孕妇,特别是18岁以下的孕妇,早产的发生率明显增加,比20~34岁的孕妇高11倍。
四、流产史
妊娠史,特别是晚期妊娠史,反复流产,人工流产,引产或流产后不满一年再怀孕对孕妇的影响最大。由于堕胎对宫颈都有不同程度的损伤,造成宫颈功能不全,增加了早产率。
五、生活环境
长期的劳作和过度的劳累,都会导致早产率明显升高。情绪波动或过度紧张会导致大脑皮层功能障碍、儿茶酚胺分泌增加、交感神经兴奋和血管收缩,容易导致早产。
如何预防并发症:
一是感染的问题
早产婴儿由于免疫系统尚未发育完全,对病毒缺乏抵抗能力,极易受到感染,一旦感染就很容易引起败血症,甚至脑膜炎,需要特别注意。
二是心血管疾病

如果早产儿肺部问题逐渐改善,就会因为动脉导管尚未关闭,而有大量的血通过动脉导管流入肺,造成心脏衰竭和肺功能变差。
三是呼吸道疾病
由于早产儿肺部发育不良,导致呼吸困难,甚至呼吸衰竭。一些体重过轻的婴儿也会出现呼吸窘迫综合征,并有呼吸短促、发绀现象。
四是肠胃系统疾病
早产婴儿容易有营养吸收不良的问题,所以最好用乳汁来喂养;即使是被迫用配方奶来喂养,也最好用少量渐进式喂养。
五是视网膜病变
早生会妨碍视网膜血管的正常发育,造成眼睛发育不良,更易近视,应在儿童眼科治疗后进行。
六是周脑室及脑室内出血
由于早产儿脑室结构不成熟,血管结构比较脆弱,极易因脑内压升高而破裂出血。如果大量出血导致脑室扩张或脑组织扩张,可能会影响神经功能,导致运动迟缓或行为障碍。
-
尿毒症大家都不陌生,一般会认为它是一种非常严重的肾脏疾病,但是对于尿毒症具体是什么,早期尿毒症有哪些症状,诱发尿毒症的因素等问题都是非常迷茫的,今天就和大家一起了解一下尿毒症的相关问题。
尿毒症是什么?
尿毒症严格来说并不是一种具体的疾病,而是各种原发性,继发性肾脏疾病引起的肾脏疾病,逐渐发展为慢性肾衰竭,身体出现的一系列综合征。如果说正常的肾脏功能有100%,在各种疾病的影响下,肾功能衰竭到仅剩10%以下时,尿毒症。
如果把身体比作一个井井有序的城市,那么肾脏就是这个城市的下水道系统,如果城市的下水道系统发生了意外,导致下水道系统发生了严重的堵塞,届时城市生活的方方面面都会受到影响,这个城市也会变得难以生存。
尿毒症虽然可怕,但是“冰冻三尺亦非一日之寒”,尿毒症在早期就已经展现出了一些症状,只是这些症状或许不曾被你留意,又或许被误诊为其他疾病。下面这些细小的蛛丝马迹,就是尿毒症的“前兆”。
尿毒症的“前兆”是什么?
尿毒症的早期症状不具有典型性,很难被发现,经常被认为是其他疾病的特征,不以为意,耽误了治疗。如果发现自己出现了这几个症状,一定要及时去医院进行诊断。
1、精神不振
日常生活中我们可能会因为各种原因导致精神状态不佳,工作繁忙,睡眠不足等,本来就非常难以和尿毒症联系在一起,稍微休养过后症状减轻,更加难以发现。
2、面色发黄
尿毒症病人在患病早期通常都会发生面色发黄的情况,这是因为尿毒症患者体内积聚的毒素过多,引发造血功能障碍,很容易误诊为贫血,导致治疗方向错误,耽误患者的治疗。
3、身体浮肿
尿毒症患者由于肾脏功能障碍,许多水分不能及时地排出体外,从而储留在身体内,导致水肿。这里和肥胖的症状很类似,都是身体逐渐“圆润”了起来,但是和肥胖那种“弹性的圆润”不同,水肿的部位受压后会出现长时间的凹陷。如果患者发现自己的脚踝发生浮肿,就应该及时去医院进行相关检查。
4、胃口不佳
由于肾脏病变加剧,尿素等原本需要经由尿液排出体外的有害物质潴留体内,当有害物质侵入消化道时,便会影响患者的食欲,出现胃口不佳的症状。如果不及时去医院治疗,后续还可能出现口腔方面的疾病,如口腔溃疡等。
5、呼吸不畅
尿毒症早期会造成机体心肺功能减弱,如果你在呼吸过程中经常不自觉地叹气或者深呼吸,那可能就是尿毒症的早期症状,不妨去医院检查一下肌酐,尿素等指标。
以上就是尿毒症的5个“前兆”,如果我们及时注意到了这些症状并及时治疗,就能一定程度上减慢疾病的发展速度,为我们赢得更多的治疗时间。这时候我们回头仔细想想:到底是哪些因素会诱发尿毒症呢?我们又应该如何针对性地去调理呢?
诱发尿毒症3大因素
致病因素一:高血压
高血压与肾病可谓是“狼狈为奸”,肾病也是引发尿毒症的重要原因之一。肾脏主要由肾小球组成,长期的高血压会损伤肾小球毛细血管,造成内壁损伤和血管硬化,引发肾脏出血,导致肾功能衰竭;肾功能衰竭又会导致肾脏供血不足,血压就会持续升高,从而造成恶性循环。
因此,高血压患者控制血压成为了治疗肾脏疾病,预防尿毒症的一种方式,我们可以通过按时服用降压药物,减少每日盐分摄入量,减轻体重等多种方式控制自身血压,从而减小高血压对肾脏的危害。
另外也要注意每年做一次的尿常规检验。如果发现自己没有尿蛋白,血压应控制在140/90mmHg以下即可;如果发现自己有尿蛋白,血压应该控制在130/80mmHg以下。
致病因素二:糖尿病
糖尿病肾病是糖尿病患者常见的并发症之一,也是各个国家尿毒症的第一大病因。糖尿病患者血糖含量变化大,内分泌代谢紊乱,可能会引发糖尿病肾病,进而引发肾衰竭,如果没有及时的治疗,最终可能进入肾衰竭终末期变为尿毒症
因此,如果自己确诊为2型糖尿病之后,至少每年都要进行一次肾脏病变的筛查检查,包括尿常规,尿蛋白/肌酐比值和血肌酐都是医生重点了解的项目;此外还需要通过控制饮食习惯,合理运动等方式积极控制血糖。
还有一点需要格外注意,蛋白质的摄入也应该适量减少,可以用低蛋白米饭代替家常主食;与此同时也要保证吃足够的蔬菜(至少每天1斤),为了更好地吸收蔬菜中的营养物质,减少叶酸等有害物质的摄入,最好可以水煮5-10分钟后再吃。

致病因素三:慢性肾小球肾炎
在我国,慢性肾小球炎是造成尿毒症的第二大原因。慢性肾小球肾炎和外界的细菌无关,是一种自身免疫疾病,具体的病理原因目前仍未可知。可能会伴随蛋白尿,血尿,水肿等临床症状。对于此种疾病,医学界还没有彻底治疗的方法,只能通过延缓疾病的进展来改善临床症状,防止并发症。
通常医生会选择激素和免疫抑制剂来治疗,包括环磷酰胺,他克莫司,环孢素A等药物,也会和一些降血压药物,利尿剂,阿司匹林等药物联合用药来控制病情。
如果发展到了后期,大部分肾小球丧失功能后,就只能通过透析来进行治疗,到那时治疗的难度和费用都将直线上升,而且会出现很多难以治疗的并发症,非常不划算。
尿毒症是肾衰竭发展到终末期后身体出现的一系列综合征。早期可能会出现几种鲜少被人注意的症状,但是不要掉以轻心,及时的治疗可以极大地延缓疾病发展,为我们争取更多的治疗时间。我们也要注意引起尿毒症的三种致病因素,及时处理,对症下药,改善自己的生活饮食习惯,用最小的成本把尿毒症扼杀在摇篮中。
-
生活中胸闷气短这种现象很常见,它是我们自身的主观感受,觉得胸口像被什么东西给压迫了,气不够用而出现呼吸急促的表现。它的严重程度要根据发病的周期、每次发病的时间、年龄以及有无基础疾病来判断。
临床上常将其分为功能性的和心脏神经官能症型或器质性病变的。功能性的如在剧烈运动、有幽闭空间恐惧症的人、心情抑郁、与他人发生争执后,以上情况下出现胸闷气短多是正常的,不用过于担心;心脏神经官能症型或器质性病变的:多数人首先会想到冠心病(心绞痛、心肌梗死),该病多好发于中老年人(40岁以上),常在过度劳累、情绪激动,受凉等诱因下发作,多是突发型的,除胸闷气短外,还会有胸骨后疼痛,常常会波及至左肩,左臂内侧,该症状一般在停止诱因活动后症状就会逐渐缓解,也可舌下含服硝酸甘油,3-5分钟即可缓解。

心肌梗死多是在心绞痛的基础上逐渐发展而来的,症状也更为严重;临床上心肌受累时也会出现相应的症状,但是这种情况多见于儿童及青少年,常常会出现心前区不适,胸闷、心悸等表现;可以引起胸闷气短的疾病还有呼吸系统疾病如肺炎、肺癌、气胸等,腹部疾病也会出现这种症状,胆囊炎、胆石症以及食管病变等均会出现该现象。
一般对于胸闷气短的检查项目有:血常规、肝功能、X线胸部透视、腹部B超、心电图等检查。通过以上检查项目,可以明确原因,确定是无病变还是病变导致,以利于治疗。

经常出现胸闷气短的患者,一定要在治疗过程中要仔细加以辨别,区分是功能性的还是病理性的。如果是功能性胸闷气短,则应该积极寻找病因,并进行必要的心理治疗,彻底消除症状。还要注意的是定期检查身体非常有必要,如果身体有病变,通过体检都能查出来。像病理性胸闷症状本身就不太明显,定期体检非常重要,这可以避免被动接受治疗的情况出现。
需要明确的是这种症状并不可怕,关键是要查清是何种疾病所致的,才能做到对症治疗,这个才是最为关键的。希望这篇文章对您有所帮助。最后,祝大家身体健康!
-
今天,我坐在新乡市的家中,打开电脑,心中带着一丝紧张和期待,开始了我的线上问诊之旅。
屏幕那头,是来自京东互联网医院的一位消化内科医生,他/她亲切地问候了我,让我感到一丝安心。‘请问您是患者本人么?’医生/她温和地询问。
我点了点头,医生/他/她便开始了详细的问诊。‘医生,请您帮我开具处方或用药建议。’我表达了来意。
医生/他/她没有立刻开药,而是耐心地询问了我的病情,包括乙肝和肝硬化的具体情况。在了解了我的病情后,医生/他/她仔细地考虑,然后给出了建议。
‘来几盒?’医生/他/她询问道。我回答了需要6盒。‘请您开这样的,谢谢!’我补充道。
‘处方创建=’医生/他/她回复道。接着,‘处方详情’的对话框出现在了我的电脑屏幕上。‘处方已送达药师审核’的消息让我感到放心。
‘已送达药师审核,审核通过后,即可预约购药。’医生/他/她告诉我。
结束了线上问诊,我感到心情舒畅。医生/他/她的专业和耐心让我深感敬佩。‘好了’我轻声说道,‘谢谢’。
医生/他/她最后说道:‘希望我的建议能够帮助到您,感谢您的信任。您的好评是对我工作最好的肯定和鼓励,欢迎您再次咨询。祝您生活愉快!’
医生的回复仅为建议;如您对该医生的服务满意,可在问诊记录中发起复诊;如需诊疗,请前往医院就诊。
-
那天,我如往常一样,独自坐在家里,手中的手机突然响起,是京东互联网医院的线上咨询。我点击进入,心中不禁有些紧张,因为医生告诉我,我的肝功能检查结果不佳,需要开始抗病毒治疗。
在对话中,我遇到了一位非常耐心和细心的医生。他首先询问了我的病情和病史,然后详细解释了抗病毒治疗的意义和必要性。虽然我心中仍有疑虑,但医生的专业知识和亲切的态度让我逐渐放下了担忧。
医生告诉我,长期抗病毒治疗是治疗慢性乙肝的最佳方案。虽然一开始需要长期服药,但只要遵循医嘱,注意生活习惯,是可以有效控制病情的。我询问了治疗期间是否有副作用,医生告诉我,虽然极少,但仍需注意。另外,抗病毒治疗期间,我需要避免饮酒,并注意个人卫生。
在治疗过程中,医生还提醒我,需要定期复查,以便及时调整治疗方案。我感到非常欣慰,因为医生不仅关注我的病情,还关心我的心理健康。他告诉我,治疗过程中可能会遇到一些困难,但只要坚持下去,一定会有所改善。
随着时间的推移,我的病情逐渐好转。医生每次的回复都让我感到温暖和力量。他不仅是一位医生,更像是一位朋友,在我最需要的时候给予了我支持和鼓励。
如今,我已经开始了抗病毒治疗,虽然生活上需要更多注意,但我相信,在医生的指导下,我一定能够战胜病魔,重拾健康的生活。
-
互联网医疗:我的就医体验 那是初秋的一个下午,我拖着疲惫的身体走进了XXX医院的互联网门诊。自从被诊断为乙肝小三阳以来,我就成了这里的常客。
医生***的面容出现在屏幕上,他的眼神温和而坚定,让我感到一丝安慰。他首先询问了我的病情,得知我正在打干扰素,便耐心地为我解释了药物的作用和可能出现的副作用。
接下来的对话,我感到医生非常专业。他详细询问了我的症状,包括痰中带血的情况,以及之前做的血常规检查的时间。我一一回答后,他建议我再次复查血常规,并考虑进行胸部CT检查。
医生还提醒我,虽然我已经打了9针干扰素,但饭后的血液检查可能会影响结果,建议我抽血前避免进食。他的细心让我深感敬佩。
在了解了我的就诊地点后,医生建议我在当地进行血常规检查,并在下午到XXX医院的互联网门诊找他。他告诉我门诊时间为下午2:30,让我不必过于紧张。
当我将今天的血常规检查结果发给医生时,他详细地分析了报告,并告诉我胸部CT报告需要后天才能取。他再次强调,医生的回复仅为建议,如需诊疗,请前往医院就诊。
通过与医生***的线上交流,我感受到了互联网医疗的便捷和专业。虽然只是线上问诊,但医生的专业素养和耐心让我深感满意。我相信,在不久的将来,互联网医疗将会成为我们生活中不可或缺的一部分。
-
那是一个阳光明媚的午后,我带着女儿来到互联网医院进行线上问诊。女儿自从出生以来,一直是我们全家的宝贝,尤其是我,更是对她呵护备至。
在互联网医院,我向一位经验丰富的医生咨询了关于女儿乙肝两对半检查结果的问题。医生非常耐心地为我解答,告诉我女儿目前的情况和需要注意的事项。
医生告诉我,女儿的乙肝两对半检查结果显示为245阳性,这意味着她有传染性。但医生也告诉我,不必过于担心,因为免疫效果好,不需要再接种乙肝疫苗或者乙肝免疫球蛋白来增强。
在医生的指导下,我了解到三岁之内每年需要查一次乙肝五项。医生还提醒我,如果三年内乙肝五项的数量较低,就需要补打疫苗。
在医生的关爱和指导下,我学会了如何照顾女儿,如何预防乙肝的传播。女儿的健康让我感到无比的安心和幸福。
这次线上问诊的经历让我深刻体会到了互联网医院的便捷和高效。医生的专业和耐心让我对互联网医疗充满了信心。
-
那天,我如往常一样,在手机上预约了在线医生进行咨询。屏幕那头,一位温柔的女医生***耐心地听我诉说,她的声音仿佛有一种魔力,能让人感到安心。
我告诉她,我身高168,体重86公斤,之前每年体检都有轻度脂肪肝,但今年9月入职体检时,肝功能指标异常,转氨酶高达140。我有些担心,毕竟身体并没有不适的感觉。
医生***细心地询问了我的用药情况,得知我曾在7月份因月经不调服用过短效避孕药,并在8月份服用过黄体酮胶囊调理后,便提出了针对性的检查建议。
她说,除了肝功能检查,还需要进行乙肝五项和丙肝抗体检查,以排除其他可能的原因。她还提醒我,轻度脂肪肝可以通过调整饮食、作息和减肥来改善。
在医生的指导下,我开始了新的生活方式,饮食变得清淡,作息规律,体重也在逐渐下降。经过一段时间的努力,我的肝功能指标逐渐恢复正常,身体也感觉更加健康。
这次线上问诊的经历让我深刻体会到,互联网医院的便利性和高效性。医生***的专业和耐心,让我对疾病有了更深的认识,也让我更加坚定了战胜疾病的信心。
-
2024年9月5日,广州市的李先生在京东互联网医院上与一位西医临床医生进行了在线问诊。李先生自述为慢性乙肝携带者,十年来一直无症状,但经常出现湿热易上火的症状。他询问医生是否可以时不时地服用龙胆泻肝丸或是煲鸡骨草加溪黄草茶来缓解症状。医生在了解李先生的病情后,告知他如果肝功能正常,病毒定量也不高,西医不建议吃药物,否则可能加重肝脏负担,对乙肝更不利。相反,医生建议李先生通过饮食和运动方式来调理身体,并定期复查肝功能、甲胎蛋白、彩超和乙肝病毒DNA定量。李先生表示自己已经在注意饮食和运动,医生的建议让他更加明确了如何更好地管理自己的健康。
-
我的线上问诊经历 那是一个平凡的下午,我坐在家中,心中有些焦虑。因为最近身体出现了一些不适,我决定尝试线上问诊。我选择了京东互联网医院,这是一个我听说过口碑不错的平台。
注册、上传病历、填写症状,一切流程都很顺畅。很快,我就收到了一位感染内科医生的回复。医生询问了我的详细情况,包括发病时间、症状以及生活习惯等。
医生告诉我,需要做一些检查,如肝功能、乙肝病毒、肝脏B超等,以确定病情。我按照医生的建议,前往附近的医院进行了检查。
几天后,医生给出了诊断结果。虽然确诊为乙肝小三阳,但医生告诉我,只要按时复查,定期治疗,病情是可以控制的。医生的专业建议让我心中的石头落地,我感到很安心。
在与医生的沟通中,我感受到了医生的专业和耐心。他不仅为我提供了治疗建议,还耐心解答了我的疑问,让我对病情有了更深入的了解。我开始定期复查,按时服用医生开具的药物。
随着时间的推移,我的病情逐渐好转。我开始感激这位医生,是他让我在遥远的家乡也能得到专业的医疗服务。现在,每当我想起那段经历,我都会心存感激。
-
那是一个阳光明媚的午后,我,一位来自河南周口的普通乙肝患者,坐在电脑前,打开了京东互联网医院,开始了我的线上问诊之旅。
医生是一位经验丰富的肝病科专家,他在详细阅读了我的病情描述后,温和地询问我是否有咳嗽、发热、卡痰等症状。我如实回答,他根据我的病情建议我肝肾功能如何,我告诉他我的肝肾功能基本正常。
在询问我是否有其他不适时,我提到了一个困扰我很久的问题:乙肝患者可不可以吃右美沙芬片?医生耐心地解释,右美沙芬片对于普通乙肝患者来说是可以服用的,但肝肾功能不全者应慎用。我如释重负,心中的大石头终于落地。
在与医生的交流过程中,我感受到了他专业的素养和耐心。他不仅解答了我的疑问,还为我提供了许多有益的建议。这让我对京东互联网医院的服务有了更深的认识,也让我对病情有了更多的了解。
通过这次线上问诊,我深刻体会到了互联网医疗的便捷和高效。在这里,我可以随时随地咨询医生,无需排队等候,节省了大量的时间和精力。更重要的是,我可以得到专业、权威的医疗建议,这对于我这种慢性病患者来说,无疑是一种福音。
-
今天,我坐在电脑前,心情有些沉重。我知道,我的身体出了些问题。我是一名来自黑龙江哈尔滨的患者,最近体检结果显示我患有乙肝小三阳。我立刻联系了京东互联网医院的肝病科医生,希望能够得到专业的建议和治疗方案。
医生首先询问了我的症状,我告诉他我最近感觉疲劳,食欲不振。医生非常耐心,他详细询问了我的生活习惯、饮食情况以及以往病史。然后,他告诉我需要做一些检查,比如肝胆脾彩超。
几天后,我再次联系医生,告诉他我还没有做彩超。医生很关切,他提醒我彩超对于诊断非常重要。我意识到自己的疏忽,立刻安排了检查。
检查结果显示,我的肝胆脾没有问题,没有肝硬化。医生告诉我,乙肝小三阳没有传染性,目前不需要抗病毒治疗。但是,他强调,乙肝患者应该定期检查肝功、肝胆脾彩超、甲胎蛋白等,以确保病情稳定。
医生的建议让我感到安心。他不仅专业,而且非常关心患者。在整个咨询过程中,他始终保持耐心,细心解答我的每一个问题。我非常感激他的专业和关怀。
通过这次线上问诊,我深刻体会到互联网医院带来的便利。不用出门,就能得到专业医生的诊断和建议,真是太方便了。我想,这将是未来医疗行业的发展趋势。
最后,我想对京东互联网医院的肝病科医生说声谢谢。是你们的付出,让我对病情有了更深入的了解,也为我提供了有效的治疗建议。
-
那天,我坐在电脑前,心情有些忐忑,准备开启我的第一次线上问诊之旅。屏幕那头,是来自***医院的刘医生,他给我的第一印象是温暖而专业。
“你好,我是刘医生,有什么问题可以告诉我。”
我简要说明了我的情况:肝功能有轻度异常,血脂偏高,而且我还有脂肪肝。刘医生耐心地询问了我的生活习惯,得知我是男性后,他给出了建议。
“目前暂时不需要药物治疗,你可以保持良好的生活方式,比如低脂饮食,加强锻炼。”
听到这里,我心中的石头终于落地了。刘医生还告诉我,一个月后需要复查肝功能。
线上问诊的过程虽然简短,但刘医生的耐心和专业让我印象深刻。在刘医生的指导下,我开始调整饮食,增加运动,一个月后,我再次进行了肝功能检查。结果如我所愿,指标有所改善。
这次线上问诊经历让我深刻体会到了互联网医疗的便捷和高效。在今后的生活中,我也会更加关注自己的健康,保持良好的生活习惯。














































