当前位置:首页>
诺华心衰治疗新药Entresto(LCZ696)获FDA批准
诺华7月7日正式对外宣布,美国食品及药品管理局(FDA)已批准Entresto片剂(此前称为LCZ696)用于治疗射血分数降低的心衰。Entresto将用于治疗NYHA II~IV级心衰患者,以降低心血管死亡和心衰住院风险。
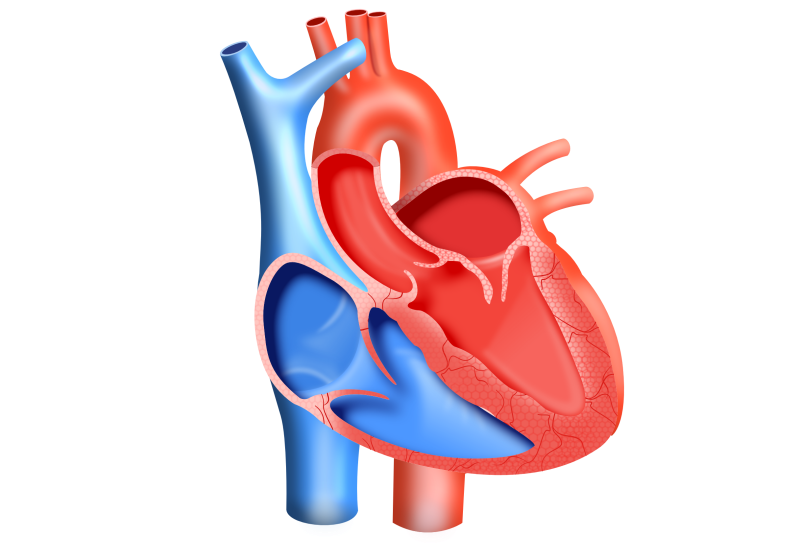
Entresto是首个血管紧张素受体脑啡肽酶抑制剂(ARNI)类药物,来降低衰竭心脏的压力。这是一种每天服用2次的片剂,其通过增强心脏的保护性神经内分泌系统(NP系统)并同时抑制有害系统(RAAS)来发挥作用。
诺华制药全球负责人David Epstein表示,“虽然存在不确定性和较高财务风险,但我们设计了全球最大规模的心衰研究,对Entresto和此前的金标准进行比较。结果显示,数以百万计的射血分数降低的心衰患者现在有更大的机会生存得更加长久且远离住院风险。我们认识到我们有责任确保将Entresto尽快提供给患者和处方医生,并且将在接下来的一周开始向美国供货。”
FDA的这一决定基于PARADIGM-HF研究在8,442例患者中得出的结果。该研究观察到Entresto与ACE抑制剂依那普利相比可显著降低心血管死亡风险,因此被提前终止。研究结束时,与依那普利组相比,Entresto组射血分数降低的心衰患者存活的几率更高且因心衰住院的几率更低。安全性数据分析显示,Entresto的耐受性与依那普利相似。
美国德克萨斯大学西南医学中心临床科学系主任Milton Packer教授表示,“PARADIGM-HF研究观察到非常有意义的Entresto的生存优势,这应当会促使医生们考虑使用Entresto代替传统ACE抑制剂或血管紧张素受体阻断剂来治疗所有合适的患者。预期Entresto将在未来几年,给射血分数降低的心衰患者的管理带来改变。”
美国有近6百万心衰患者,并且约半数患者罹患射血分数降低的心衰。根据症状对体力活动的限制程度,其中约220万患者为NYHAII~IV级心衰。心衰是一种危及生命的状态,患者心脏无法泵出足够血液供给全身。患者发生死亡和反复住院的风险较高,并且可出现呼吸困难、疲劳和液体潴留等症状,进而显著影响生活质量。
包括加拿大、瑞士和欧盟在内的全球各地的卫生管理机构目前正在对Entresto进行审评。一旦被全球卫生管理机构批准用于治疗射血分数降低的心衰,预计Entresto的销售额将有望突破50亿美元。
Entresto目前尚未在中国获得批准。
本站内容仅供医学知识科普使用,任何关于疾病、用药建议都不能替代执业医师当面诊断,请谨慎参阅
-
总交流次数
33
医生回复次数
16
患者:女
-
总交流次数
27
医生回复次数
14
患者:男 54岁
-
总交流次数
17
医生回复次数
7
患者:女 57岁
-
总交流次数
27
医生回复次数
15
患者:男 5个月11天
-
总交流次数
15
医生回复次数
9
患者:女 1岁10个月
-
总交流次数
33
医生回复次数
17
患者:女 22岁
-
总交流次数
15
医生回复次数
8
患者:男 39岁
-
总交流次数
14
医生回复次数
7
患者:男 33岁
-
总交流次数
54
医生回复次数
36
患者:女 2岁
-
总交流次数
17
医生回复次数
15
患者:男 40岁
-
经过国家医保局的谈判和酝酿,新版国家医保目录近期终于与大家见面了。新版目录最引人关注的,莫过于74种新药首次进入目录,且平均降价61.71%。除了抗肿瘤药物之外,新版目录同样为广大糖尿病患者带来了福音,2个降糖新药被纳入医保,它们分别是司美格鲁肽注射液和二甲双胍恩格列净片。今天,我们就来认识一下这2个降糖新药,看看它们有何特点。

司美格鲁肽注射液
相信许多糖友们都听说过或者使用过艾塞那肽、利拉鲁肽或者度拉糖肽吧?没错,司美格鲁肽也是这一家族中的成员之一,都属于胰高血糖素样肽1(GLP-1)受体激动剂,该类药物的作用机制除了可刺激胰岛素分泌外,与其他类药物所不同的是还能够降低胰高血糖素分泌来达到双重降糖的作用。
从全球开展的多中心大型临床研究结果显示,无论是单药还是联合其他口服或者基础胰岛素治疗,司美格鲁肽均可显著降低糖化血红蛋白(HbAlc)水平,最高降幅可达到1.8%,可使糖尿病患者HbAlc达标率(<7%)高达86.1%。另外,司美格鲁肽对心血管还具有保护作用,能够改善多项心血管代谢指标,包括血压、血脂和体重等心血管病高危因素,可显著降低主要心血管不良事件发生风险达26%,降低非致死性卒中风险达39%。
总之,这两个降糖新药进入最新医保目录,让广大糖友们在降糖药物的选择上又多了个选择,不得不说是广大糖友们的福音。
二甲双胍恩格列净片
两种具有协同作用的药物组合,在近年来越来越流行用于心血管疾病的治疗,例如降压药厄贝沙坦氢氯噻嗪片。现在,降糖药组合套装也来了,二甲双胍恩格列净片就是其中之一。二甲双胍和恩格列净单药本身就是2型糖尿病治疗的一线药物,且都具有多种降糖作用以外的保护作用,例如改善胰岛素抵抗、降低体重、改善血脂代谢等。
另外,恩格列净还能够降低血压和尿酸水平,对心脏和肾脏具有保护作用。有研究结果显示,二甲双胍联合恩格列净治疗比各自单药治疗能够更显著降低HbAlc、甘油三酯、胆固醇和低密度脂蛋白水平,且不良反应发生率未见明显升高,可见二甲双胍和恩格列净联合使用是安全有效的,这样的组合不仅性价比更高,患者服用更加方便,还能够有效保护糖友们的心脏和肾脏,可谓是相得益彰。
总之,这两个降糖新药进入最新医保目录,让广大糖友们在降糖药物的选择上又多了个选择,不得不说是广大糖友们的福音。参考文献:
[1]《钠-葡萄糖共转运蛋白2(SGLT2)抑制剂临床合理应用中国专家建议》
-
国家食品药品监督管理局(SFDA)近日正式批准选择性血管加压素(AVP)Ⅱ型受体(简称V2受体)拮抗剂托伐普坦(商品名为苏麦卡)在中国生产并销售。
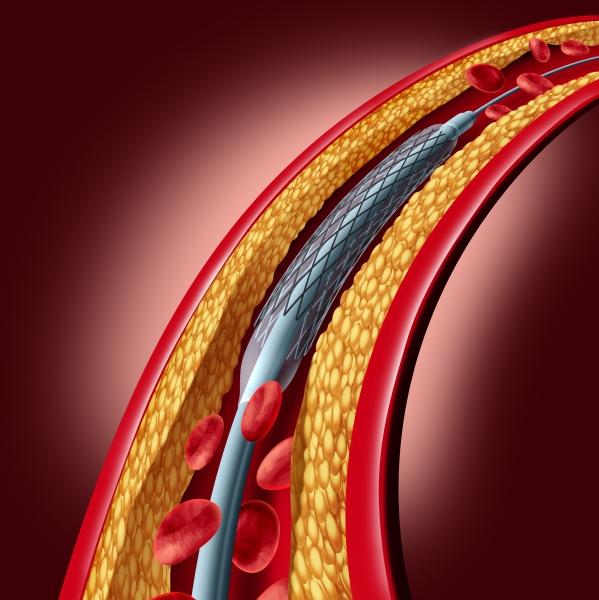
托伐普坦是世界上首个口服普坦类药物,也将是中国市场第一个V2受体拮抗剂,可用于治疗因肝硬化、心衰、抗利尿激素分泌异常综合征(SIADH)所导致的高容量性和等容量性低钠血症。AVP又称抗利尿激素,在下丘脑合成,储存在垂体后叶,是调节人体水平衡最主要的激素。当人体血容量降低或血浆渗透压增高时,AVP从垂体后叶中释放进入血循环。AVP受体有 V1A、V1B和 V2,其中V2受体主要分布于肾脏集合管,负责调节水在原尿和血液间的转运,以维持人体体液平衡。
正常人血中几乎测不出AVP的存在。没有AVP时,肾脏集合管内膜是不透水的,多余水份从尿液中排出。心衰、肝硬化、SIADH等疾病可导致体内AVP水平增高,增高的AVP与V2受体结合并激活V2受体,刺激水通道蛋白2合成,在内膜上形成孔道,使自由水经由集合管内腔进入细胞,继之入血,从而增加水的重吸收,导致血容量不成比例增加及稀释性低钠血症。患者可表现出恶心、意识障碍、昏睡、注意力缺失、步态不稳和意外摔倒等症状,低钠严重时可出现惊厥、昏迷,甚至死亡。
目前对高容量性和等容量性低钠血症尚无有效的治疗方法。在临床上,限制液体摄入常被作为首选方法,但患者很难做到,即便患者严格遵守了限液医嘱,其提高血钠的幅度也不超过3~4 mEq/L。对肝腹水和心衰患者,因可能加重高容量状况从而使病情进展,故不建议采用滴注高渗盐水来纠正低钠血症。而现有利尿剂均通过抑制钠的重吸收来增加尿量,故在低钠血症时不推荐使用。
托伐普坦的诞生给这些患者带来了新希望。其与V2受体的亲和力是天然AVP的1.8倍,可拮抗AVP的作用,抑制水的重吸收,增加不含电解质的自由水排出,有效纠正高容量性和等容量性低钠血症,并可纠正高容量患者的水肿症状。
国内外多项临床试验为托伐普坦的有效性和安全性提供了有力证据。该药口服后2~4小时即出现排水和升高血钠浓度作用,8小时后血钠显著增高,在至少1年的研究期内,患者的血钠得以维持。常见不良反应(≤5%)为口干和口渴。中国注册临床试验也验证了国外临床试验结果。
托伐普坦的问世将为肝硬化、心衰、SIADH导致的高容量性和等容量性低钠血症患者带来全新治疗选择。
-
全球领先的生物制药公司艾伯维今天宣布,维建乐(奥比帕利片)联合易奇瑞(达塞布韦钠片)丙肝治疗方案已于2018年3月2日获得中国国家食品药品监督管理总局(CFDA)批准,治疗基因1b型、初治、轻度至中度肝纤维化(F0-F2)慢性丙型肝炎患者,疗程可缩短至8周,是中国首个获批的8周治疗方案。这是该方案于2017年9月在华获批上市后不足半年时间内获得的第二项突破。此方案为全口服,无干扰素,包含3种直接抗病毒药物,可针对丙肝病毒生命周期的3个主要靶点,抑制丙肝病毒的复制。
“维建乐和易奇瑞治疗方案的8周新疗程在中国获批,再次体现了艾伯维为中国丙肝患者提供创新且高效治疗方案作出的努力。我们期待更多的中国丙肝患者通过优化的治疗方案,尽早摆脱疾病的困扰。”艾伯维中国总经理欧思朗表示,“作为全球丙肝领域的重要参与者之一,艾伯维未来还将持续为中国市场引入最新的产品。”
此次获批基于一项3b期临床研究(GARNET)数据的支持。结果显示,无肝硬化(F0—F2)的初治基因1b型丙型肝炎患者,使用维建乐联合易奇瑞方案连续治疗8周后,持续病毒学应答率(SVR12)达99% (n=147/148)。
北京大学人民医院肝病研究所所长魏来教授表示:“目前,中国已上市的丙肝直接抗病毒(DAAs)方案治疗周期普遍在12周以上。奥比帕利片(维建乐)联合达塞布韦钠片(易奇瑞)治疗方案对于基因1b型、初治、无肝硬化(F0—F2)丙肝患者的8周疗程是迄今为止最短的,对于这部分患者可减少药物暴露量,降低医疗成本,有助于提高依从性。”
丙肝是全球面临的重大公共卫生挑战。中国约有1000万丙肝病毒感染者,其中基因1b型最为常见,感染者比例达56.8%。
“我国公众对丙肝的认知度低,检测率低,诊断率低,治疗率则更低。2017年我国报告的丙肝患者超过24万余例,防控形势严峻。奥比帕利片(维建乐)联合达塞布韦钠片(易奇瑞)对轻、中度肝纤维化的1b型丙肝患者的8周治疗方案,将为中国丙肝的防治提供更有力的支持,推动‘2030年消除病毒性肝炎这一严重的公共卫生威胁’目标的实现。”中国工程院院士、中华医学会肝病学分会名誉主任委员庄辉教授表示。
-
吉利德科学公司(NASDAQ:GILD)5月30日宣布,国家药品监督管理局批准丙通沙(索磷布韦400 mg /维帕他韦100 mg)可用于治疗基因1-6型慢性丙型肝炎病毒(HCV)的成人感染患者。国家药品监督管理局同时批准丙通沙联合利巴韦林(RBV)可用于丙肝合并失代偿期肝硬化的成年患者。丙通沙是中国首个通过审批的泛基因型HCV单一片剂方案(STR)。

丙通沙能够在中国获得批准,主要基于五项国际多中心3期临床研究,即ASTRAL-1、ASTRAL-2、ASTRAL-3、ASTRAL-4和ASTRAL-5。在很难治愈的患者群体(包括经治患者,以及代偿期或失代偿期肝硬化患者)中,SVR12(定义为完成治疗后的第12周,检测不出HCV RNA)的总体实现率较高,为92%-100%。
“丙通沙的安全性和有效性已被大量的临床试验和真实世界的数据证实,”北京大学人民医院肝病研究所魏来教授说,“由于丙通沙对所有基因型的丙肝患者都有高治愈率,我们在治疗时有望免除基因分型的检测,这对扩大丙肝治疗有积极意义。”
在中国,HCV是第四大常见传染病,约有1000万人受到感染。其中,HCV 基因1、2、3和6型占全部病例的96%以上。
在ASTRAL-1、ASTRAL-2和ASTRAL-3研究中,1,035名不伴肝硬化/伴代偿期肝硬化的基因1-6型HCV感染的初治患者和经治患者接受了12周的丙通沙治疗。98%(1,015/1,035)的患者实现了SVR12。在ASTRAL-5 的研究中,106名不伴肝硬化/伴代偿期肝硬化的基因1-6型HCV感染的初治患者和经治患者接受了12周的丙通沙治疗,他们还同时感染了HIV, 正在接受平稳的抗逆转录病毒治疗。其中,95%(101/106)的患者实现了SVR12。
ASTRAL-4研究评估了267名失代偿期肝硬化(Child-Pugh B级)的基因1-4型和基因6 型 HCV感染患者接受12周丙通沙联合/不联合利巴韦林(RBV)治疗或者24周的丙通沙治疗的安全性和有效性。其中,接受了12周的丙通沙联合RBV治疗的失代偿期肝硬化的患者,实现了94%(82/87)的SVR12。
在ASTRAL-1、ASTRAL-2、ASTRAL-3和ASTRAL-5中,接受丙通沙治疗的患者最常见的不良反应(≥10%)包括头痛和疲乏。在ASTRAL-1研究中,安慰剂组的患者出现头痛和疲乏的频率与之相似。在ASTRAL-4中,伴有失代偿期肝硬化的HCV感染患者接受丙通沙和利巴韦林(RBV)治疗后最常见不良反应(≥10%)包括疲乏、贫血、恶心、头痛、失眠和腹泻。四名服用丙通沙联合RBV的患者由于不良反应而停止治疗。
“作为首个无需考虑HCV患者基因型和肝纤维化程度、每日一次的单片剂治疗方案,丙通沙在很大程度上简化了中国医生对丙肝患者的治疗,同时有望在公共卫生层面减轻HCV带来的巨大负担,”吉利德科学公司总裁兼首席执行官John F. Milligan博士表示,“吉利德已经在中国推出了两种直接抗病毒治疗方案,而且我们始终致力于为患者的筛查和治疗工作提供相应的支持,以助力解决中国的HCV流行问题。”
2016年,丙通沙获得了美国食品药品监督管理局(FDA)和欧盟委员会的上市许可,成为了首个用于HCV感染的泛基因型单一片剂方案。此外,丙通沙也已在54个国家获批。
索华迪(Sofosbuvir)作为单片制剂,在2017年获得中国食品药品监督管理总局的批准,是联合抗病毒治疗方案的重要组成部分,用于治疗基因1,2,3,4,5 或者6 型的成人和青少年( 12-18 岁,基因2和3型)HCV感染患者。
-
近年来,在世界范围内新兴起一种权威的医学研究方法,那就是循证医学研究。循证医学研究以大范围、多样本、随机双盲为特点,是目前医学界最科学的药效评价标准,通过循证医学研究能得出国际公认的药物疗效,能选出让医生和患者信赖的临床药物。

客观、公正、全面的药效评价标准
与传统重视理论及医生个人经验的药效评价标准相比较,循证医学研究更为看重实实在在的证据,而证据就是患者身上的各种疾病表现、各种检查指标以及用药后症状改善的情况等。为了保证研究结果的客观、公正、全面,循证医学研究人员必须按照大范围、多样本和双盲实验这三个原则来收集证据。
大范围,意味着循证医学研究要收入大量的病例,这些病例所患的疾病是相同的,然后再分成用药组和对照组,用药组使用一种药物治疗,对照组采用另一种药物治疗,最后拿出两组结果一对照,就能看出两种药物哪种疗效更好,哪种副作用更小。
多样本,则是研究中收入的病例要多种多样。因为每个人的自身条件是有差别的,比如年龄不同、体质不同、生活环境不同等等,而这些因素都会对药效造成影响,因此循证医学研究要求收入的病例具有多样性,要求尽可能找到各种情况的患者,这样才能全面地反映出所研究的药物对各种不同情况患者的治疗效果。
双盲实验,是在整个循证医学研究过程中,医生与患者都不知道自己使用的是哪种药物,是对照组的药物、还是用药组的药物他们都不知道。只有到了最后揭盲的时候,按照药物编号统计出结果来,大家才知道对照组的疗效怎么样,用药组的疗效又如何。这样一来,就可以从最大程度上保证研究结果的客观性。
大范围、多样本、双盲实验的三项原则,有力地保证了研究结果的客观、公正、全面,从而使循证医学研究成为最科学的药效评价标准。
芪苈强心胶囊 走上循证之旅
作为目前世界医学界最科学的药效评价标准,循证医学研究结论被视为真正可值得医生和患者信赖的用药依据。在现实中,要启动一项循证医学研究绝非易事,除了需要有大量、规范、严格的实验临床研究数据的支持、大量高水平医院的参与、众多医学专家的协同合作之外,还有一点非常重要,那就是巨大的勇气。因为循证医学研究完全有可能得出对试验药品不利的结论,如果药品生产者没有一定勇气的话,很难下决心冒这个险。
不过,这一研究却是能让我国中医药的卓越疗效得到世界认可的一个重要契机。因此,我国一些中成药也走上了循证医学研究之旅,如参松养心胶囊、连花清瘟胶囊,这些药物都经受住了循证医学研究的考验。芪苈强心胶囊也不例外,为了进一步验证该药治疗慢性心衰的有效性和安全性,毅然决然走上了这一最为权威、最为科学的药效评价之旅。
2011年6月25日,由中国工程院高润霖院士、张伯礼院士、黄峻教授、韩雅玲教授、吴宗贵教授、马爱群教授、杨杰孚教授、李为民教授、李新立教授、张健教授及中华医学会心血管病分会心衰学组共同组成的学术委员会,联合国内23家综合三甲医院开展的“随机、双盲、安慰剂平行对照评价芪苈强心胶囊治疗慢性心衰患者有效性与安全性的多中心临床试验”(QL-BACD 试验)循证医学研究正式启动。为了达到大范围、多样本、随即双盲的要求,这次研究在全国范围内收集了大量病例,涵盖了各发病年龄段、各种症状的心衰患者。研究者将患者随机分为试验组和对照组,试验组在心衰西医标准化治疗的基础上加服芪苈强心胶囊,每次四粒,每天三次;对照组在心衰西医标准化治疗的基础上服用芪苈模拟剂(安慰剂),每次四粒,每天三次。旨在评价芪苈强心胶囊对慢性心衰患者血清氨基末端B型利钠肽前体(NT-proBNP)的影响,同时评价芪苈强心胶囊对慢性心衰患者生活质量等指标有效性及安全性的影响,以期为慢性心衰的中西医结合治疗提供临床依据。其中,NT-proBNP的水平随心衰程度加重而升高,能够早期反映心脏结构改变导致的功能变化,可用于指导心衰的治疗,有助于判断各种心衰患者的远期预后,NT-proBNP水平降低30%以上是一个较好的治疗目标。
历经一年多时间,2012年9月16日,芪苈强心胶囊的循证医学研究揭盲,结果令人振奋,研究结果显示:芪苈强心可显著降低慢性心衰患者血清NT-proBNP水平,优于对照组;NT-proBNP水平下降超过30%的比例优于对照组。次要疗效指标评价结果显示:芪苈强心显著改善慢性心衰患者生活质量优于对照组;芪苈强心显著改善慢性心衰患者心功能(NYHA心功能分级)优于对照组;芪苈强心显著提高慢性心衰患者左室射血分数(LVEF)优于对照组;芪苈强心改善慢性心衰患者6分钟步行距离优于对照组;芪苈强心显著降低复合终点事件发生率优于对照组。
参与芪苈强心胶囊循证医学研究的专家们一致肯定,芪苈强心胶囊是目前唯一经循证医学研究评价证实治疗慢性心衰疗效确切的中成药,是广大医生和心衰患者最可信赖的安全、有效的心衰治疗药物。
-
上一篇文章带大家了解了心律失常的相关知识,今天带大家详细了解一下抗心律失常药物。
一、抗心律失常药物分类:
- 目前临床上将药物抗心律失常作用的电生理效应作为分类依据,分为四大类:
第一类是阻断快速钠通道的药物,又分为三个亚类:
- ⅠA 类主要是通过延长动作电位时长来达到抗心律失常的作用,代表药物是奎尼丁、普鲁卡因胺。
- ⅠB 类主要是通过缩短动作电位时长来达到抗心律失常的作用,代表药物是美西律(慢心律)、利多卡因;适用于治疗各种急慢性室性心律失常。
- ⅠC 类是通过减慢传导和轻微延长动作电位时长来达到抗心律失常的作用,代表药物是普罗帕酮(心律平),用于治疗室上性心律失常(对室性心律失常也有一定作用)。
第二类药物是阻断β肾上腺素能受体的药物,代表药物是美托洛尔和比索洛尔。主要用于治疗需要控制的窦性心动过速、室性期前收缩和室上性期前收缩。是目前已明确的可以改善病人长期预后的抗心律失常药物。
第三类药物是阻断钾通道与延长复极的药物,代表药物是胺碘酮。治疗各种室上性、室性的快速性心律失常。
第四类药物是阻断慢钙通道的药物,代表药物是维拉帕米和地尔硫卓。维拉帕米主要用于治疗各种室上性心动过速,包括预激综合征,房颤、房扑时可减慢心室率。地尔硫卓临床上主要用于变异型心绞痛患者。
二、常用抗心律失常药物适应症、禁忌症及不良反应:
1.盐酸美西律片(慢心律)
- 用法用量:一次 150~200mg(3~4 片),一日 2~3 次。
- 适应症:主要用于慢性室性心律失常,如室性早搏、室性心动过速。
- 禁忌症:心源性休克和有 II 或 III 度房室传导阻滞,病窦综合征者禁用。
- 不良反应:恶心、呕吐、运动失调、震颤、步态障碍、皮疹;心脏方面:低血压(发生在静脉注射时)、心动过缓。
2.盐酸利多卡因注射液
- 适应症:本品可用于急性心肌梗塞后室性早搏和室性心动过速,亦可用于洋地黄类中毒、心脏外科手术及心导管引起的室性心律失常。 本品对室上性心律失常通常无效。
- 禁忌症:对局部麻醉药过敏者禁用;阿-斯氏综合征(急性心源性脑缺血综合征)、预激综合征、严重心传导阻滞(包括窦房、房室及心室内传导阻滞)患者静脉禁用。
- 不良反应:眩晕及不同程度意识障碍;心脏方面:少数引起窦房结抑制、房室传导阻滞。
3.盐酸普罗帕酮片(心律平)
- 用法用量:一次 100~200mg(2~4 片),一日 3~4 次。
- 适应症:主要用于各种类型室上性心动过速;室性期前收缩,难治性、致命性室速。
- 禁忌症:无起搏器保护的窦房结功能障碍、严重房室传导阻滞、双束支传导阻滞患者,严重充血性心力衰竭、心源性休克、严重低血压及对该药过敏者禁用。
- 不良反应:眩晕、味觉障碍、视物模糊;胃肠道不适;可能加重支气管痉挛;心脏方面:窦房结抑制、房室阻滞、加重心力衰竭。
4.酒石酸美托洛尔片(倍他乐克)
- 用法用量:一次 12.5~50mg(1/2~2 片),一日 2 次。
- 适应症:控制需要治疗的窦性心动过速;症状性期前收缩;心房扑动/心房颤动;多形性及反复发作单形性室性心动过速;预防上述心律失常再发;降低冠心病、心力衰竭病人猝死及总死亡率。
- 禁忌症:心源性休克。病态窦房结综合征。Ⅱ、Ⅲ度房室传导阻滞,不稳定的,失代偿性心力衰竭患者(肺水肿、低灌注或低血压),持续地或间歇地接受β受体激动剂正变力性治疗的患者。有症状的心动过缓或低血压。本品不可给予心率<45 次/分、P-Q 间期>0.24 秒或收缩压<100mmHg 的怀疑急性心肌梗死的患者,伴有坏痈危险的严重外周血管疾病患者。对本品中任何成份或其它β受体阻滞剂过敏者。
- 不良反应:加剧哮喘与 COPD;间歇性跛行、雷诺现象、精神抑郁;糖尿病病人可能引起低血糖、乏力;心脏方面:低血压、心动过缓、充血性心力衰竭、心绞痛病人突然撤药引起症状加重、心律失常、急性心肌梗死。
5.盐酸胺碘酮片(可达龙)
- 用法用量:第一周一次 0.2g(1 片),一日 3 次;第二周一次 0.2g(1 片),一日 2 次;第三周开始一次 0.2g(1 片),一日 1 次。
- 适应症:适用于危及生命的阵发室性心动过速及室颤的预防,也可用于其他药物无效的阵发性室上性心动过速、阵发心房扑动、心房颤动,包括合并预激综合征者及持续心房颤动、心房扑动电转复后的维持治疗。可用于持续房颤、房扑时室率的控制。尤其适用于器质性心脏病、心肌梗死后伴心功能不全的心律失常。除有明确指征外,一般不宜用于治疗房性、室性早搏。
- 禁忌症:严重窦房结功能异常者禁用;Ⅱ或Ⅲ度房室传导阻滞者禁用;心动过缓引起晕厥者禁用;对本品过敏者禁用。
- 不良反应:转氨酶升高;光过敏,角膜色素沉着;胃肠道反应;甲亢或甲减;心脏方面:心动过缓,致心律失常很少发生,偶尔发生尖端扭转性室速。
以上就是有关抗心律失常药物的一些知识,希望大家通过阅读这篇文章能够有所收获。
-
国内第一个PD-1类抗癌药物上市,历史性突破!
2018年6月15日,对中国的肺癌患者而言,这一天具有重大历史意义!因为就在这一天,中国国家药品监督管理局正式批准了欧狄沃(纳武利尤单抗注射液,nivolumab injection)上市!
纳武利尤单抗注射液属于PD-1免疫抑制剂,该药可用于治疗不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
欧狄沃的上市,开启了中国肿瘤治疗新篇章,正如广东省人民医院终身主任,肺癌研究大咖吴一龙教授的评价:”作为第一个在中国获批的免疫肿瘤治疗药物,欧狄沃将为医生及中国经治非小细胞肺癌患者提供新的治疗选择,并让部分患者实现长期生存,具有划时代的意义。”
能够成为第一个国内上市的PD-1免疫抑制剂,欧狄沃经历了大型国内临床试验的考验,也就是说,欧狄沃在中国非小细胞肺癌患者中的疗效和安全性得到认可!通过在启动的PD-1抑制剂临床研究,研究对象90%为中国人,和传统化疗药比较,使用欧狄沃后1年生存率明显提高。伴随着随访时间的延长,我们很有希望看到中国第一批把肺癌变成慢性病的长期幸存者。这真的是非小细胞肺癌患者的福音!
那么PD-1免疫抑制剂究竟是什么药?近年来程序性细胞死亡蛋白-1(programmed death-1,PD-1)及其配体(PD-L1)抑制剂是肿瘤免疫疗法研究的热点,作为免疫哨点单抗药物,其应答之广度、深度、和持久性均十分罕见,是近年来肿瘤免疫疗法研究的热点。

此类药物研发成功,能够阻断肿瘤细胞内的PD-1的过度活性,要知道,肿瘤细胞的PD-1分子过度表达,会抑制免疫细胞,而PD-1免疫抑制剂能阻断这一通路,恢复免疫功能,使这些细胞能够继续杀伤肿瘤细胞。
但让人非常遗憾的一点是,此药费用昂贵,一瓶2万元左右,年花费百万!这对很多家庭而言,无疑是天文数字!
目前,我国药品监管部门大力改革,为促进抗癌新药尽快上市做出了卓越努力,目前国内高发的肝癌、胃癌、食管癌等疾病的III期大规模临床试验也正在积极进行,PD-1免疫抑制剂的成功上市无疑是打响了头炮,情况一定会越来越好的,它激励我们把癌症变成慢性病,让我们一起努力实现这个伟大目标!
-
什么是重组活化凝血因子Ⅶ?
诺其(Novoseven®),重组活化人凝血因子VII,由诺和诺德公司研制生产,用于治疗存在有因子VIII(FVIII)和因子IX(FIX)抗体(抑制物)的先天性血友病和继发性血友病患者的自发性或手术性出血。这种重组蛋白是从新生仓鼠肾细胞克隆的人因子Ⅶ基因中表达出来的,生产的整个过程或最终产品都没有用到任何人源性的材料。

分子结构图药理剂量的诺其能够在‘活化’血小板表面将FⅩ转化为FⅩa。经过一系列复杂的步骤,FⅩa在损伤部位形成血凝块。非常重要的一点是:正常情况下,血小板只在损伤局部活化——因此能够防止在不需要形成血栓的部位形成血栓。这种独特的作用机制可以解释为什么诺其在没有因子Ⅷ和Ⅸ的情况下也能够安全有效地止血。
诺其产品图目前,诺其已在全世界范围内被批准用于存在有抑制物的先天性血友病的治疗;在欧洲,诺其亦被批准用于获得性血友病的治疗。
以往对于存在有抑制物的患者,可行的治疗方案不多,而且这些治疗方法在安全性和有效性方面均存在有局限。如何治疗这些患者发生的威胁生命和肢体功能的严重出血,仍然是一个巨大的挑战。许多患者死于无法控制的出血;因出血而导致的重度关节损害的问题仍然十分严重;对有抑制物的患者进行手术时如何止血,尤其是一个特殊的难题。在过去,由于没有有效的药物可以保证手术安全地进行,大部分存在有抑制物的血友病患者均无法进行择期的手术治疗。
因为可避免人类病毒的污染,基因工程制备的重组因子浓缩剂的问世,使血友病患者治疗的安全性得到了明显的提高。然而,由于许多存在有抑制物的血友病患者还在接受着血浆和血液制品的治疗,发生感染性和非感染性并发症的危险性仍然存在,其中一些甚至是致命的(如全身性感染和急性肺损伤)。有些血浆衍生凝血因子浓缩剂可引起血栓症.
诺其治疗推荐的标准剂量为90~120mcg/kg,初始时每间隔2小时予此剂量快速输注,然后减少给药间隔。临床研究证实,存在有抑制物的患者,无论是存在有同种异体抗体的血友病A和血友病B患者,还是存在有自身抗体的获得性血友病患者,诺其90 mcg/kg的剂量均可有效(有效率80~90%)并且安全地确保止血。
存在有抑制物的血友病患者,早期开始治疗,例如将诺其作为一线药物,疗效最佳。
因子VII缺乏的患者曾被予以诺其20~30mcg/kg治疗。对这一患者群治疗的经验正在迅速地积累(17,18)。给予诺其治疗后,存在有抑制物的血友病患者或因子VII缺乏的患者均可以进行手术治疗,而其发生严重的出血或合并症的危险性很低(2,4,18)。诺其在治疗先天性和获得性血友病领域取得的成功,使其相关研究已扩展到血友病以外的其它出血性疾患的治疗上。 -
南力农和米力农(milrinone)对非衰竭心肌的正性肌力和正性舒张效应要强于中度和终末期衰竭的心肌。南力农显著增强健康心脏来源的右心房小梁的心肌收缩力以及提高收缩强度上升或下降的峰速率,但对中度或终末期心衰的心脏却没有此效应。然而,在心脏组织经过考福新(colforsin)或异丙肾上腺素的预刺激(prestimulation)后,南力农也可增加心衰心脏的收缩力。临床研究:在8位慢性失代偿心衰患者中,2mg南力农给药显著提高运动时的总体和局部左心室射血分数(LVEF)。心室区的隔膜部、顶部和外侧部的功能都有改善。

在另外的一项研究中,14位NYHAII-III级心力衰竭患者单次口服2mg南力农可以减小外周血管阻力(SVR)、肺毛细血管楔压(PCWP)和肺动脉压。显著提高心脏指数(CI)。8周后,用南力农治疗的6位轻到中度心力衰竭患者的血液动力学的改善要显著好于使用安慰剂的5位患者。在试验期间,患者仍然继续使用利尿剂、洋地黄及ACE抑制剂进行常规治疗。
药代动力学研究显示:在年龄为18-44岁的健康人群中研究了单次给药的药代动力学,试验显示南力农空腹血药峰浓度与给药剂量成正比。药物代谢为一级动力学模式,消除半衰期是5.2小时,消除半衰期无剂量依赖性。胶囊剂型的生物利用度略高于水溶液剂型。与食物同服可以延长药物的达峰时间。健康老年自愿者接受1mg的南力农或安慰剂单次给药,女性的药物峰浓度(Cmax)和AUC值提高;年龄超过70岁的人AUC值也提高。
26位心力衰竭而且左心室射血分数<50%的患者在给药利尿剂的同时随机接受安慰剂(病例数=27)、或日三次口服南力农0.5mg(33人),1mg(33人)或2mg(33人)的治疗,时间为12周。南力农0.5mg和1mg剂量组的患者中运动时间增加。但南力农对6分钟步行测试或Lee标准测试的结果没有影响。所有的南力农试验组的患者SIP指数(SicknessImpactProfile)都有改善,但安慰剂组的SIP值没有显著改善。
南力农的不良反应在临床研究中观察到头晕与头痛不良反应,当空腹给药时,不良反应更常见。
-
百时美施贵宝(BMS)与合作伙伴大冢(Otsuka)近日宣布,FDA已批准抗癌药Sprycel(施达赛,通用名:dasatinib,达沙替尼)产品标签更新。此次更新,将纳入Sprycel治疗新诊慢性期(CP)费城染色体阳性(Ph+)慢性髓性白血病(CML)成人患者的5年疗效和安全数据,以及Sprycel治疗对既往疗法(包括格列卫Gleevec)产生耐药或不耐受的CP Ph+ CML患者的7年疗效和安全数据。

随着医学技术的进步,CML已经成为一种可以管理的慢性病,但患者需要接受持续的治疗以及评估治疗的里程碑,以便更好地管理疾病。此次更新的5年和7年数据,将为Sprycel一线和二线治疗CP Ph+ CML的长期疗效和安全性提供有价值的见解。这些长期数据,对于CML患者的临床护理非常重要。
Sprycel(施达赛)是一种慢性髓性白血病(CML)治疗药物,该药是一种孤儿药,治疗成本高达15万美元/人/年,是全球最昂贵的药品之一。诺华是CML领域的领导者,有2种药物获批:Gleevec(格列卫)和Tasigna(尼罗替尼,nilotinib);其中格列卫价格高达8.4万美元/人/年。由于Gleevec和Sprycel只是将CML转变为慢性疾病,其高昂价格备受批评,印度政府已颁发强制许可,准许本土制药商强仿。
DASISION研究(CA180-056):
DASISION是一项开放标签、随机、国际III期临床研究,在新诊CP Ph+CML患者中开展,将每日一次100mg剂量Sprycel(n=259)与每日一次400mg剂量Gleevec(n=260)进行了对比。主要终点是12个月时确认的完全细胞遗传学缓解(CCyR),次要终点包括任何时间点的主要分子生物学缓解(MMR)、实现MMR的时间、实现确认CCyR的时间。研究至少随访5年,在最后分析时,Sprycel治疗组有61%患者、Gleevec治疗组有62%患者仍在接受治疗。
数据显示,在12个月后,与Gleevec治疗组相比,Sprycel治疗组有更高比例的患者实现确认的CCyR主要终点(77% [95% CI,6 71% - 82%] vs 66% [95%, CI, 60% - 72%],p=0.007)。随访5年,Sprycel治疗组实现确认CCyR的比例为83%(n=215),实现确认CCyR的中位时间为3.1个月;Gleevec治疗组数据分别为79%(n=204)和5.8个月。
治疗1年后,与Gleevec治疗组相比,Sprycel治疗组更可能实现MMR(52% [95% CI, 46% - 58%] vs. 34% [95% CI, 28% - 40%],p<0.0001),这是更深治疗缓解的一种评价措施。在长期(5年),Sprycel治疗组任何时间的MMR均高于Gleevec治疗组(76% [95% CI, 71% - 82%] vs 64% [95% CI, 58% - 70%])。
Dose Optimization研究(CA180-034):
该研究是一项开放标签、随机、剂量优化研究,旨在评估对格列卫(Gleevec)有耐药性(n=497)或不耐受(n=173)的CP Ph+CML患者中评估Sprycel的疗效和安全性。研究中,670例CML患者随机分配至4个组:100mg每日一次(n=167)、50mg每日2次(n=168)、140mg每日一次(n=167)、70mg每日2次(n=168)。
数据显示,所有Sprycel 4个治疗组均取得了治疗疗效,每日一次方案与每日2次方案在主要疗效终点(MCyR差异2%; 95% CI [-7% – 11%])疗效相当(非劣效性)。然而,100mg每日一次治疗方案表现出更高的安全性和耐受性。
随访7年,44%患者仍然存活,25%生存数据未知,其余31%患者已经死亡。100mg每日一次治疗组,有9例患者尽管接受治疗但在7年治疗期间转为加速期或急变期CML。随访2年时,100mg每日一次治疗组有63%([95% CI: 56% - 71%])的患者实现主要细胞遗传学缓解(MCyR),达到了研究的主要终点。





